BCJ:双特异性抗体治疗多发性骨髓瘤的现状及未来
时间:2024-10-08 16:01:12 热度:37.1℃ 作者:网络
双抗治疗多发性骨髓瘤
多发性骨髓瘤仍无法治愈,但其治疗模式正在不断变化。一线使用达雷妥尤单抗等单克隆抗体与蛋白酶体抑制剂(PI)和免疫调节剂(IMiD)可以显著提高生存率和预后,但在复发时也会带来独特挑战。CAR-T细胞疗法和双特异性抗体(BsAbs,简称双抗)已成为复发性多发性骨髓瘤的重要治疗选择。
双抗是一种双抗原靶向构建物,通过B细胞膜抗原(BCMA)、G蛋白偶联受体家族C组5成员D(GPRC5D)和Fc受体同源物5(FcRH5)等多种靶抗原使T细胞与浆细胞结合,已证明可在既往接受过多线治疗的骨髓瘤患者中诱导产生深度和持久的缓解,可管理和可预测的副作用,包括感染和低级别细胞因子释放综合征(CRS),以及“现货供应”的优势,使双抗成为现有抗骨髓瘤治疗中有前景的补充。
《Blood Cancer Journal》近日发表万字综述,重点介绍了目前使用和开发中的各种双抗的最新数据,包括疗效、安全性、耐药机制及克服策略、一线治疗的开发等。

双特异性抗体和BITE
基于T细胞的免疫疗法已导致许多恶性肿瘤治疗的范式转变。双抗是一种具有2个结合位点的抗体,可以结合两种不同的抗原或同一抗原的2个表位,它们可以同时结合肿瘤细胞(结合肿瘤靶细胞上的肿瘤特异性抗原)和免疫效应细胞(结合T细胞CD3共受体)。另一方面,BITE(双特异性T细胞衔接器)是由两个单链可变片段(ScFv)组成的工程构建物,作为双靶向分子。这种免疫突触可引起T细胞活化和脱颗粒,导致MM细胞壁穿孔,通过穿孔素和颗粒酶B导致细胞凋亡;此外还通过引起T细胞活化、增殖和幼稚T细胞分化为具有记忆表型(中枢记忆和效应记忆T细胞)的T细胞来调节T细胞功能。
三特异性抗体(TsAbs)则更进一步,加入一种共刺激蛋白来降低T细胞能量,或者可以靶向另一种靶抗原。
浆细胞上的治疗靶点
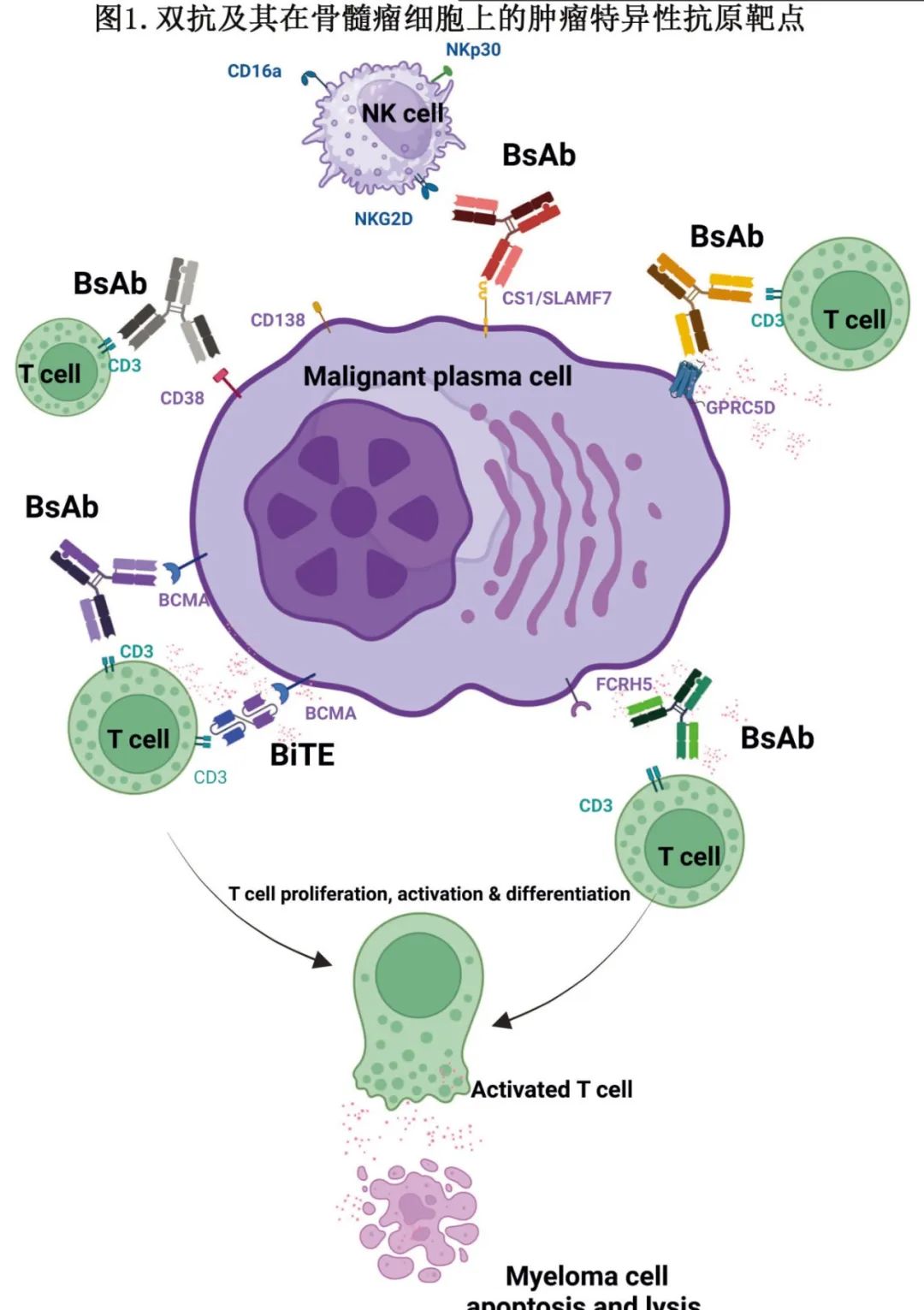
为了最大限度地提高疗效和降低毒性,双抗应靶向一种独特且对多发性骨髓瘤细胞具有特异性的抗原,并且在其他健康组织中的表达量最少。目前已批准和正在试验的MM双抗靶向浆细胞上的BCMA、GPRC5D、FcRH5和CD38。其他肿瘤特异性抗原如浆细胞SLAMF7和CD138,以及其他效应细胞靶点如CD16a、NKp30或NKG2D,也都处于治疗探索阶段。
BCMA
BCMA也称CD269,是肿瘤坏死因子受体(TNFRSF17)超家族的3型跨膜结构域蛋白,编码于染色体16p上,在正常和恶性浆细胞上均有高水平表达,是骨髓瘤治疗的理想靶抗原。它与其配体TNF家族B细胞激活剂(BAFF)和增殖诱导配体(APRIL)一起传递促存活细胞信号,调节B细胞增殖、成熟、存活以及向浆细胞分化;其表达在骨髓瘤的发病和演变过程中上调,包括从正常到MGUS到SMM再到活动性骨髓瘤。高水平的BCMA与较差的预后相关,表明BCMA是MM疾病活动性和预后的有用生物标志物。一种普遍存在的称为γ分泌酶的膜内蛋白酶可切割膜结合的BCMA,并将其作为可溶性BCMA(sBCMA)释放到循环中,从而降低浆细胞上的配体密度,并可能降低结合sBCMA的治疗性抗体。由于BCMA也在成熟的B细胞和浆细胞上表达,因此其功能与体液免疫应答高度相关。目前已有两种BCMA双抗(特立妥单抗[特立妥单抗]和elranatamab)获得FDA批准,其中特立妥单抗已在中国上市。
GPRC5D
GPRC5D是最近发现的一种新的骨髓瘤免疫治疗靶点,这种孤儿G蛋白偶联受体是一种跨膜受体蛋白,由12p染色体上的 GPRC5D基因编码,在恶性浆细胞表面高表达,但其功能尚不清楚。GPRC5D在几乎所有健康组织中都不表达,除了硬角化结构,包括毛干、汗腺上皮细胞、指甲和舌的丝状乳头。此外,与其他血液系统恶性肿瘤相比,GPRC5D在MM细胞中的表达也较高。与BCMA类似,GPRC5D在骨髓瘤细胞上的高表达与预后不良有关。尽管GPRC5D和BCMA在CD138+恶性浆细胞上表达相似,但其表达模式彼此独立,因此可提供不同的临床靶点。GPRC5D的表达也不受BCMA丢失的影响,该现象可在 BCMA靶向治疗后的复发中看到;这一独特优势不仅允许在 BCMA治疗失败后使用GPRC5D靶向药物,还支持BCMA联合GPRC5D靶向药物治疗骨髓瘤的策略。此外,由于其细胞外N端结构域较短,GPRC5D也不太可能从靶细胞脱落到血清中,从而降低了与靶抗原脱落相关的疗效降低风险。有2个 GPRC5D×CD3双抗(talquetamab,forimtamig)正在临床试验中研究。在MonumenTAL-1研究结果公布后,FDA于2023年8月加速批准talquetamab,而forimtaming已停止临床开发。
FcRH5
FcRH5是免疫球蛋白超家族中的一种表面膜蛋白,在抗原启动B细胞的发育过程中与增殖和同型表达有关;其表达仅限于B细胞谱系,其表达始于前B细胞,并通过成熟至成熟B细胞和浆细胞而增加。FcRH5在恶性浆细胞中的表达也高于正常浆细胞。FcRL5也称为FcRL5,其基因在 1q21染色体断裂点表达,与1q21获得相关的骨髓瘤可导致FcRL5过表达。流式细胞分析显示,与GPRC5D和BCMA相比,FcRH5在多发性骨髓瘤患者骨髓浆细胞样本中的表达更为普遍,但GPRC5D的表达比FcRH5更为强烈和均匀,而BCMA表达最少。尽管一种FcRH5抗体药物偶联物DFRF4539A的I期临床试验没有成功,但在接受cevostamab(一种靶向FcRH5的双抗)治疗的患者中,可以看到增强且持久的疗效。
CD38
CD38是MM细胞上的II型跨膜糖蛋白,多年前首次被确定为细胞活化和增殖的标志。MM细胞表面CD38的高表达与免疫受损的肿瘤微环境(TME)密切相关。有氧糖酵解和CD38糖蛋白提供的酸性骨髓微环境,促进AMP和腺苷的生成,具有强大的免疫抑制活性。基于达雷妥尤单抗和艾沙妥昔单抗的成功,后续开发靶向 CD38双抗。ISB 1342(GBR 1342)是第一个开发的 CD38×CD3 双抗,将T细胞定向与达雷妥尤单抗不同表位上表达CD38的骨髓瘤细胞。临床前研究表明ISB 1342不与达雷妥尤单抗竞争,可诱导强大的MM细胞裂解并克服对抗CD38单抗的耐药性。ISB 1342在RRMM患者中的一期试验正在进行中(NCT03309111)。
图1总结了骨髓瘤细胞上的各种肿瘤特异性抗原,以及双抗结合的各种T细胞和NK细胞受体。
双抗单药治疗复发和难治性骨髓瘤的疗效
表1总结了双抗单药治疗RRMM的主要临床试验的疗效数据。

基于开创性的MajesTEC-1研究,特立妥单抗成为首个获批治疗RRMM患者的双抗。165例患者中77.6%为三药难治,中位随访22个月的长期随访中,43%的患者达到完全缓解(CR)或严格意义的CR;中位无进展生存期(mPFS)和中位总生存期(mOS)分别为12.5个月和21.9个月;可评估患者中85.7%在任何时间获得MRD阴性,>6个月持续MRD阴性的患者占56.1%,>12个月持续阴性的患者占38.9%。与接受超过3线LOT治疗的患者相比,早期治疗的患者PFS显著改善(21.7个月vs 9.7个月)。在继续接受研究的49例患者中,90%正在接受每2周1次的剂量。
MajesTEC-1研究的中国队列数据显示,在26例既往 LOT中位数为5线的患者中,57.7%有高危细胞遗传学,34.6%有髓外病变,ORR为76.9%,VGPR≥76.9%,CR≥57.7%;12个月时中位PFS和OS分别为68.0%和83.5%。1/2期日本 MMY1002研究也显示类似疗效数据(n=26,高危19.2%,既往LOT中位数为4.5线),ORR为76.9%,46.1%患者≥CR。
在美国真实世界回顾性数据中,24例患者也显示了良好预后。所有24例患者均为三类难治,10例患者接受过抗BCMA治疗(双抗,BCMA ADC和BCMA CAR-T),其中5例患者接受过≥2种抗BCMA治疗。患者最早在16天时就观察到缓解。ORR为60%(9/15可评估患者),接受过BCMA治疗的患者的ORR为50%(5/10)。在较短的中位随访(1.3个月)中,该研究表明,尽管接受过BCMA治疗的疗效降低,但特立妥单抗在重度经治患者群体中仍有效。
一项3期研究(MajesTEC-9, NCT05572515)目前正在招募RRMM患者,以比较单药特立妥单抗与其他标准治疗方案(泊马度胺、硼替佐米、地塞米松或卡非佐米、地塞米松)的疗效。
Elranatamab是一种人源化抗BCMA/CD3双特异性IgG2抗体,基于2期MagnetisMM-3研究,于2023年8月获得FDA批准用于治疗至少接受过四线治疗的RRMM患者,包括蛋白酶体抑制剂、免疫调节剂和抗CD38单抗。Elranatamab以递增剂量给药,目标剂量为76mg。接受QW给药至少6个周期并持续至少2个月达到≥PR的患者将其给药间隔改为Q2W。123例患者中96.7%和42.3%的患者为三类难治和五药难治,既往中位治疗线数为5线。在长期随访中,61%的患者达到总缓解,其中39%达到≥CR。92%(23/25)的可评估患者达到MRD阴性(10-5)。在 17.6个月随访时,中位PFS为17.2个月,中位OS为24.6个月,12个月率分别为57.1%和62%。
Linvoseltamab是另一种全人源化抗BCMA×CD3 双抗,在2期 LINKER-MM1 (REGN5458)研究中作为2个剂量(50mg和200mg)单药治疗进行研究,该研究纳入在接受≥3线治疗期间/后进展的患者,包括PI、IMiD和CD38 单抗。前14周每周治疗1次,之后每2周治疗1次。既往治疗的中位线数为5线,81%为三类难治。研究方案允许在4~12周期间发生进展的患者将剂量从50 mg增加至200 mg。200mg的疗效较好,甚至在50mg的疾病进展后也有效。在接受200mg治疗的117例患者中,39%有高危细胞遗传学,28%为五药难治。中位随访14.3个月,ORR为71%,50%达到≥CR。在接受50mg剂量治疗的107例患者中,ORR为48%,21%的患者在中位随访7.4个月后达到≥CR。基于LINKER-MM1研究早期有希望的数据, Linvoseltamab最近获得FDA的优先审查,用于经过≥3线治疗后出现进展的患者。
ABBV-383(TNB-383B)是靶向BCMA的下一代全人源化双抗,与 CD3具有低亲和力结合,不需要递增剂量。在一项1期研究中,在RRMM患者中显示出持久的反应和可控的毒性(≥3线既往治疗)。在剂量扩大队列的剂量≥40mg Q3W时,ORR为68%,≥VGPR为54%,CR为36%。两队列的中位DOR和PFS均未达到。高亲和力的BCMA结合加上对CD3的低亲和力,可以减少T细胞的激活和耗竭,减少炎症细胞因子的产生,同时保持最大疗效。
Alnuctamab(CC 93269)是另一种双抗,具有2条不对称臂,携带人源化IgG1 T细胞接合体,与BCMA双价结合,与CD3非共价结合。尽管在首次人体I期研究≥6mg的队列中ORR为83.3%,但已退出临床开发。
另一种抗BCMA×CD3双抗 F182112在1期研究中,中位随访3.1个月的ORR为43.8%。
Pacanalotamab(AMG420)和pavurutamab(AMG701)是BCMA×CD3 BiTE。尽管早期1期研究获得良好结果,但随后均退出进一步的临床开发。
Talquetamab是首款靶向骨髓瘤细胞GPCR5D和T细胞CD3的 IgG4 双抗类药物。在2期MonumenTAL-1研究(n=375)评估了talquetamab单药但分为2种剂量:0.4 mg/kg QW(n=143,中位随访29.8个月)和0.8 mg/kg Q2W(n=154,中位随访23.4个月)。纳入既往接受过至少4线治疗的患者。在两周一次剂量下73.6%达到ORR,中位随访时间为8.6个月,58%的患者达到≥VGPR,其中33%达到≥CR;在0.4 mg QW剂量下,73%达到ORR,57%的患者在14.9个月的中位随访中达到≥VGPR (包括35%的≥CR)。反应较为持久,0.8 mg/kg Q2W组的中位缓解持续时间未达到,0.4 mg/kg QW组的为9.5个月。
MonumenTAL-1研究还包括78例接受过双抗或CAR-T细胞治疗的患者(94%接受过抗BCMA治疗),这些患者接受0.4 mg/kg QW的talquetamab治疗。中位随访20.5个月,67%达到ORR, 42.4%达到≥CR,达到≥CR的患者中位缓解持续时间为 24.2个月。继MonumenTAL-1数据之后,美国FDA于2023年8月加速批准talquetamab治疗成人RRMM患者。
Forimtamig是另一种GPRC5D×CD3双抗,具有GPRC5D的2个结合结构域,对恶性浆细胞具有高亲和力。一项剂量递增I期研究对重度经治MM患者采用静脉(IV)和皮下(SC)给药对评估Forimtamig,所有患者均接受预防性类固醇治疗以减轻CRS。在两个剂量组中均观察到有效的抗MM作用(IV组 ORR为71.4%、≥VGPR为59.2%,SC组为63.6%、52.8%)。中位缓解持续时间为10.8~12.5个月。在接受过抗BCMA治疗(CAR-T细胞治疗、双抗或ADC)的患者中ORR为52.4%。该药物已停止临床开发。
Cevostamab是一种FCRH5×CD3双抗,在一项I期剂量探索研究中显示出有希望的抗MM活性,该试验招纳入重度经治患者(n=161,中位6线;三类难治患者84.5%)。Cevostamab每3周静脉注射一次,最多17个周期(约1年),并预先用药以减轻CRS(对乙酰氨基酚、抗组胺药和皮质类固醇)。较高剂量水平下ORR为56.7%(≥VGPR 33.3%)。单次递增治疗队列的中位缓解持续时间为11.5个月。对16例在缓解期停止治疗的患者进行亚组分析显示,大多数应答者(78%)仍保持应答(中位随访时间9.6个月)。此外,因不良事件停止cevostamab治疗的患者(中位治疗时间6个月)能够维持其疗效,治疗停止后的中位缓解持续时间为9.2个月。这些数据表明,对于 1年时仍处于缓解期的患者,固定疗程治疗可能有效,从而凸显了长期无治疗的潜力,并可能很快成为骨髓瘤的一个新趋势。虽然有吸引力,但该数据需要在更大的患者队列中进行验证,并进行更长时间的随访。
联合用药的疗效
受双抗作为RRMM单药治疗效果的鼓舞,一些研究也测试了其联合其他双抗或抗骨髓瘤药物。主要研究总结于下文和表2。
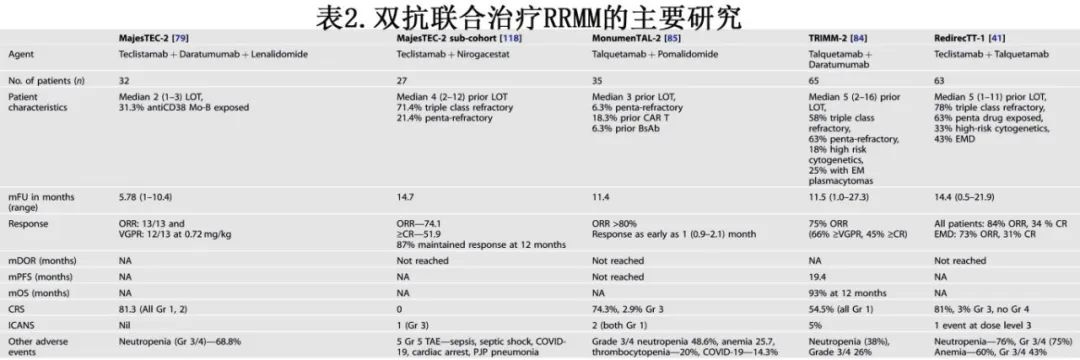
1b期MajesTEC-2研究评估了特立妥单抗治疗RRMM的各种组合。在一个队列中,研究者将特立妥单抗与达雷妥尤单抗和来那度胺联合用药;达雷妥尤单抗可消耗 CD38+ Tregs,促进细胞毒性T细胞的激活和克隆扩增,而IMiDs(泊马度胺和来那度胺)可增强T细胞反应,并改善体外双抗的细胞杀伤。32例既往治疗中位数为2线的患者接受每周剂量的特立妥单抗(0.72或1.5 mg/kg,递增剂量)联合达雷妥尤单抗1800 mg和来那度胺25mg的标准剂量和方案。至首次缓解的中位时间为1个月。在0.72mg/kg组,中位随访8.6个月,13/13的可评估患者获得ORR, 12/13达到≥VGPR;在1.5 mg/kg组,13/16例可评估患者在中位随访4.17个月时获得ORR。这些令人兴奋的早期结果将在3期MajesTEC- 7研究中进行评估,比较特立妥单抗、达雷妥尤单抗、来那度胺和达雷妥尤单抗、来那度胺、地塞米松联合治疗作为不适合或不打算自体干细胞移植的NDMM患者的初始治疗。
TRIMM-2研究评估SC talquetamab联合达雷妥尤单抗治疗RRMM,并显示出令人鼓舞的结果]。既往治疗的中位数为5线,其中63%为五药难治,58%为三类难治,其中18%为高危细胞遗传学,25%为髓外病变(EMD)。ORR为75%(66% ≥VGPR, 45% ≥CR)且反应随时间加深。对于既往治疗暴露或难以治疗的患者,抗CD38的患者ORR为75%/76%,抗BCMA的患者为74%/64%,双抗的患者为75%/75%。至首次缓解的中位时间为1个月。12个月时86%的应答者仍维持缓解。
1b期MonumenTAL-2研究评估了在talquetamab中加入泊马度胺,在2个不同剂量水平的talquetamab递增治疗后,从第2周期开始加用泊马度胺。两种剂量下的 ORR均>80%,且早在1个月个月就有反应,表明该联合用药的疗效良好。
1b期RedirecTT-1研究评估了特立妥单抗联合talquetamab,同时靶向两种MM靶抗原以克服耐药机制。既往治疗中位数为5线(78%为三类难治, 63%为五药暴露,33%为高危细胞遗传学,43%为髓外病变),ORR高达92%。中位随访14.4个月,ORR为84%,≥CR为34%。在推荐的2期剂量(RP2D)下,所有可评估患者的 ORR为92%,其中髓外病变患者ORR为83%。尽管 ORR很高,但髓外病变患者的中位PFS仅为6.1个月,RP2D组的中位PFS为9.9个月,表明双抗的双重靶向仍未克服髓外病变引起的高风险。RedirecTT-1的第 3部分专门在RRMM伴髓外病变患者中评估该联合方案。
有许多正在进行和即将进行的研究正在评估单独使用双抗或联合其他药物,其中部分研究见表3。

安全性和副作用
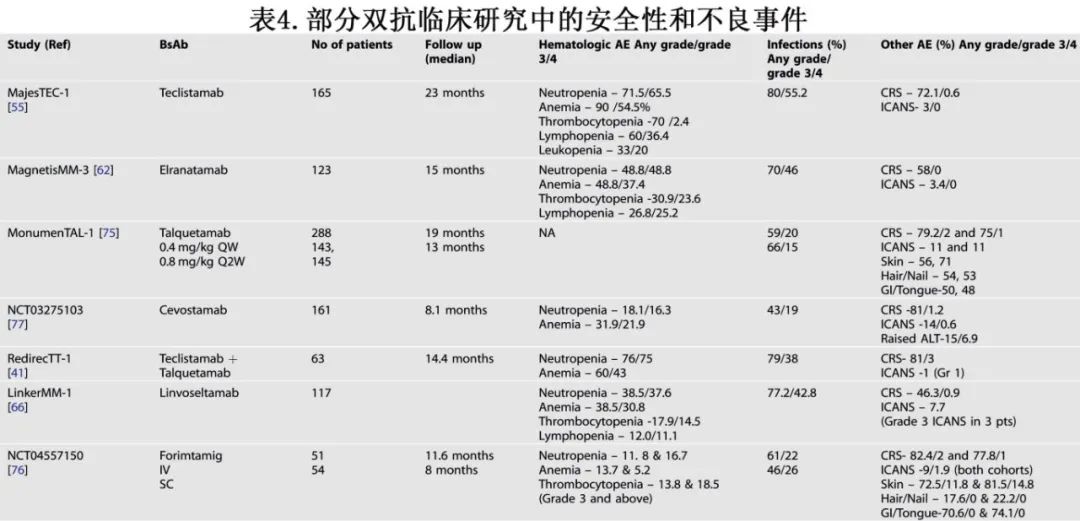
尽管有深刻而持久的反应,但在RRMM中使用双抗也具有独特挑战。常见的不良事件包括感染、血细胞减少、CRS和神经毒性。表4总结了双抗的各种血液学和主要非血液学不良事件。
非骨髓瘤相关死亡
目前双抗只有1/2期研究数据,使得OS难以解释。鉴于骨髓瘤治疗史,如维奈克拉、melflufen和帕博利珠单抗,在早期研究中显示出有希望的疗效,但在随机研究OS降低,评估这些早期双抗研究中的非骨髓瘤死亡很重要。特立妥单抗(27/165,16%)和 Elranatamab(18/123,15%)均显示出大量非骨髓瘤死亡,主要死于感染,尤其是COVID-19,需在更大规模的3期随机研究中密切关注。Talquetamab未观察到这一信号,而Cevostamab需要更多随访数据。
感染
感染是双抗最常见的治疗相关不良事件,由于BCMA在成熟B细胞和正常浆细胞上的表达及其在产生体液免疫中的作用,抗BCMA 双抗的风险最大;双抗持续刺激T细胞导致的T细胞耗竭也会降低T细胞介导的免疫应答能力。临床前研究表明,小鼠模型中抑制BCMA可阻止抗体对高抗原蛋白和肺炎疫苗的反应。接受T细胞定向抗BCMA治疗(包括双抗)的RRMM患者对COVID疫苗的反应减弱。在特立妥单抗MajesTEC-1研究中(随访时间最长)3-4级感染的发生率为55.2%。
在MajeTEC-1研究的亚组分析中,特立妥单抗显著且持久地抑制多克隆免疫球蛋白和B细胞计数。此外,与新诊断MM或复发/难治性MM患者相比,接受特立妥单抗治疗的患者对肺炎链球菌、B型流感嗜血杆菌和严重急性呼吸综合征冠状病毒2疫苗的应答严重受损。类似地,其他BCMA双抗(elranatamab和 linvoseltamab)报道感染也高达70%(40%为3级和4级)。
但抗GPRC5d双抗的感染发生率较低,因为它们诱导的B细胞消耗要低得多,因此降低低丙种球蛋白血症的等级。Talquetamab的≥3级感染发生率约为20%。但需要更多的长期随访数据来了解抗FcRH5双抗 cevostamab的感染情况。
针对疱疹、水痘和肺孢子菌的一级普遍预防是标准手段;常规抗菌或抗真菌预防的作用尚不清楚,也不作为常规推荐。静脉注射或皮下注射免疫球蛋白预防可减轻体液免疫缺陷,并可显著降低抗BCMA治疗的重度感染发生率。目前建议,如果IgG< 400mg/dL,则每月进行免疫球蛋白替代治疗,且在免疫麻痹的整个持续时间内继续给予免疫球蛋白替代治疗(即使在BCMA 双抗治疗期间没有感染)。还强烈建议常规接种COVID-19疫苗、每年接种流感疫苗、肺炎球菌疫苗和疱疹疫苗。COVID-19死亡率很高,快速识别和治疗COVID-19对于接受BCMA双抗治疗的患者至关重要。
血细胞减少
血细胞减少是双抗治疗的另一个常见不良事件,主要发生在疾病活跃的第1周期。在所有级别和类型的血液学毒性(中性粒细胞减少、贫血、淋巴细胞减少、白细胞减少和血小板减少的总和)方面,非BCMA双抗与 BCMA双抗之间没有显著差异;但BCMA双抗的3-4级血液学毒性较高。特立妥单抗、elranatamab和ABBV-383的≥3级中性粒细胞减少发生率分别为65%、48%和26%。此外来那度胺/BCMA联合治疗的3/4级中性粒细胞减少率非常高。3-4级中性粒细胞减少的负担也增加重度感染的风险,与中性粒细胞减少相关的感染可能危及生命,导致治疗延迟和剂量降低,进而影响治疗效果。建议使用粒细胞集落刺激因子(G-CSF)治疗3-4级中性粒细胞减少。G-CSF不应在CRS活跃期使用,因其可导致细胞因子释放,导致CRS的潜在恶化。此外,对于使用G-CSF仍未改善的长期中性粒细胞减少,可考虑抗菌和抗真菌预防。
细胞因子释放综合征
细胞因子释放综合征(CRS)是细胞毒性T细胞激活和随后炎症细胞因子释放的结果。在所有双抗研究中,大多数患者都报告了所有级别的CRS(范围为46.3-82.4%),但≥3级CRS的发生率非常低(范围为0-3%)。大多数CRS事件发生在剂量递增期间或第一次全剂量之后,谨慎监测CRS、递增剂量给药、合理使用托珠单抗和其他支持性治疗可以成功地减轻风险。在MajesTEC-1研究的一个亚队列中,与整个队列相比,预防性使用单剂量托珠单抗可显著降低CRS的发生率,且没有任何额外的安全性信号,也没有对治疗疗效产生任何影响。另一项针对cevostamab(抗FcRH5×CD3双抗)的I期临床研究显示,预防性使用托珠单抗可显著降低CRS的风险,而不会对疗效产生任何负面影响。该策略是临床关注的领域,或可降低适合门诊给药的患者的CRS风险,减少增加给药期间的住院负担。CRS率也可能因国家而异,可能是患者或治疗因素的结果,例如日本患者的CRS率和严重程度明显更高。MajesTEC-1研究中国队列中也出现较高的CRS率,尽管级别较低。
ICANS/神经毒性
免疫效应细胞相关神经毒性综合征(ICANS)虽然不像CAR- T细胞治疗那样常见,但却是双抗的另一个重要副作用。一般而言,ICANS通常发生于治疗的较早阶段,包括剂量剂量和首次全剂量,从最近一次给药到发病的中位时间为2天(范围1-3天)。双抗中神经毒性主要为1-2级ICANS(范围1-14%),而≥3级的发生率较低(范围0-11%)。最常见的临床表现为意识错乱和书写困难。类固醇是主要治疗手段,如果患者同时发生CRS,也可以使用托珠单抗;大多数患者经治疗后恢复良好。在MagnetisMM-3研究中,elranatamab观察到的另一个显著神经系统副作用为周围神经病变(17.1%发生运动功能障碍,13.8%发生感觉神经病);多为轻度,只有1例患者出现3级运动功能障碍;没有患者发生3级感觉神经病变,也没有发生4级或5级事件。
皮肤、指甲和口腔不良事件
对于GPRC5D双抗,影响皮肤、指甲和口腔黏膜的毒副作用较为常见,因为这些受体在硬角化结构中共表达,包括毛干、汗腺上皮细胞、指甲和舌头的丝状乳头。在1期MoumenTA L-1研究中,talquetamab 405μg剂量组57%的患者和800μg剂量组27%的患者发生指甲相关不良事件;分别有67%和70%的患者发生皮肤相关不良事件。最常见的皮肤相关不良事件为剥脱、瘙痒和皮肤干燥。405μg剂量水平组未报告皮疹相关3级不良事件,但800μg剂量水平组有16%发生3级不良事件。
重度3级皮疹对口服和外用糖皮质激素敏感,除1例患者外,所有患者在皮疹消退后均恢复治疗。口腔相关不良事件发生率高,但均为1级或2级,包括味觉障碍、口干和吞咽困难。减少剂量或延长两次给药间隔时间等策略可在不影响临床疗效的情况下减轻这些副作用。Forimtamig发生皮肤相关副作用(≥3级的发生率,IV组和SC组为11.8%和14.8%),而没有患者报告重度口腔或毛发和指甲相关不良事件。
耐药机制和增强疗效的策略
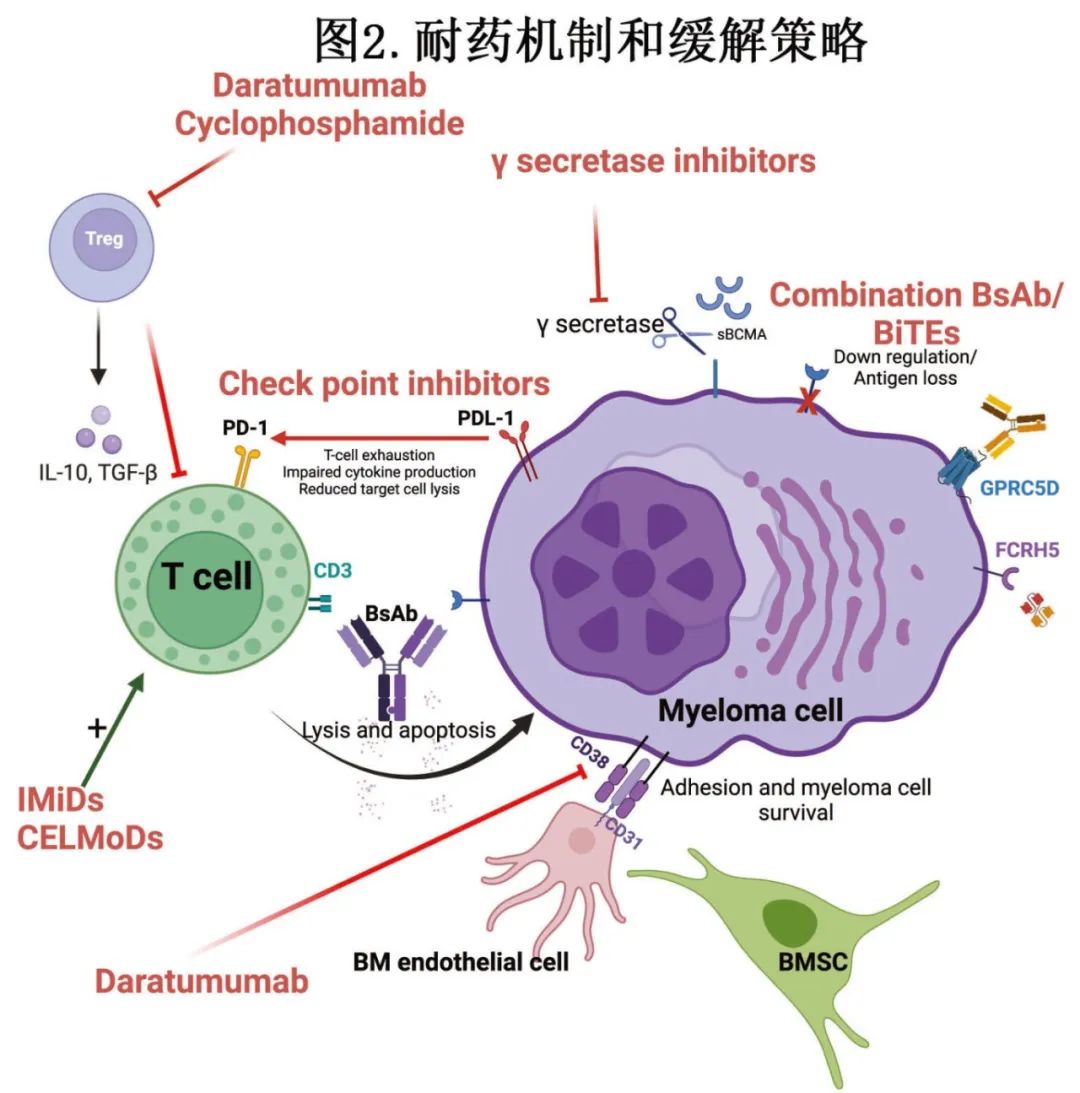
尽管早期数据令人鼓舞,但也有报道对双抗治疗的反应丧失,反应很大程度上取决于T细胞免疫环境和诱导持久抗肿瘤反应的能力。双抗的关键耐药机制包括高肿瘤负荷、T细胞健康度(fitness)和细胞库,以及MM细胞突变和靶点丢失。
高肿瘤负荷(如骨髓浆细胞>60%、ISS 3期和髓外病变)会对双抗治疗MM的临床疗效产生不利影响。临床前数据表明,低比例效应细胞/肿瘤和高频率Tregs预示着MM对双抗的反应不佳。特立妥单抗的体内研究表明,基线时Tregs升高和T细胞表型耗竭预示无反应。获得性耐药机制包括T细胞耗竭、抗原逃逸和MHC I类丢失,特别是由于双抗持续给药的选择性压力,导致BCMA突变或缺失的发生率很高。需要新的方法来克服这些机制,以增加对双抗有反应的患者比例,并创造有利的长期免疫状况。与新诊断MM或前驱疾病相比,效应T细胞功能在多线治疗和复发时受损严重。目前正在进行的许多研究正在寻求将双抗转移到早期治疗阶段,包括新诊断、ASCT后巩固和早期复发。
BCMA表达的突变或缺失可导致耐药。膜结合BCMA是γ分泌酶的底物,它直接从浆细胞中脱落BCMA,导致循环系统可溶性BCMA(sBCMA)水平增加,导致APRIL和BAFF与BCMA的结合减少,双抗的靶点可用性降低。sBCMA水平随着疾病进展而升高,并与不良预后相关。在MajesTEC研究中,尽管基线sBCMA水平变化很大且与疗效无关,但sBCMA水平升高与不良预后相关。在临床前研究中,加入γ分泌酶抑制剂可在体外增强BCMA 双抗诱导的MM细胞杀伤,通过提高抗原可用性而增强肿瘤控制和提高生存率,从而快速清除sBCMA。多队列、开放标签、1b期 MajesTEC-2研究的一个组的早期结果也已证明这一点,该研究评估了特立妥单抗联合多个剂量水平的nirogacestat,ORR为57%~92%。然而由于治疗相关不良反应(包括剂量限制性3级胃肠道出血、3级ICANS及感染性休克和心脏停搏导致的死亡),导致对联合用药的安全性提出担忧。
靶抗原丢失也可能发生,其在BCMA CAR-T细胞治疗中很少报道,而在BCMA双抗治疗中较为常见。双等位基因缺失或单拷贝数变异导致GPRC5D缺失,为抗GPRC5D T细胞靶向治疗后复发的重要肿瘤内在驱动因素。结合具有不同靶点或多个表位的药物或同时结合多个 双抗可以绕过这些障碍。
骨髓瘤骨髓TME的特征在于MM细胞、免疫细胞和骨髓基质细胞(BMSC)之间复杂的相互作用,损害正常的免疫功能,促进MM细胞的增殖和生存,导致治疗失败和疾病进展。MM中免疫抑制调节性T细胞(Tregs)增加,MM还可增强其作用。骨髓瘤细胞也可以通过ICOS/ICOS- l介导,以不依赖接触的方式直接产生功能性Tregs。MajesTEC-1研究的一项分析显示,对特立妥单抗没有反应的患者外周血CD8+ T细胞水平低、T-regs增加、与T细胞耗竭相关的标志物表达增强;也与较差的生存率相关。将双抗与增强T细胞功能的治疗剂结合可提高疗效。烷化剂环磷酰胺可通过消耗Tregs和促进细胞毒性T细胞活性来改善效应T细胞反应,还可通过将T辅助细胞从 Th2型扭曲为Th1型来增强双抗活性所需的记忆细胞毒性T细胞的扩增。在小鼠模型中发现,在BCMA双抗中添加环磷酰胺有效,从而为提高疗效提供了一种有前途的方法。达雷妥尤单抗也可以减少免疫抑制性T和B调节细胞,以及骨髓源性抑制细胞(MDSC),并导致克隆T细胞扩增,特别是在重度经治患者中,该原理正在复发和一线临床环境中以多种组合进行评估。
双抗和其他T细胞定向疗法持续抗原刺激引起的T细胞耗竭和功能障碍是双抗治疗失败的另一个原因。免疫调节剂(IMiD)和小脑E3连接酶调节剂(CELMoD)可增强T细胞反应,许多临床前研究已经显示该协同作用。免疫效应细胞治疗前给予来那度胺或泊马度胺可增强BCMA 双抗介导的MM细胞杀伤。在小鼠模型中,将泊马度胺、iberdomide或mezigdomide与BCMA×CD3双抗Alnuctamab联合使用可有效增强T细胞活化和肿瘤清除。这些药物可能是双抗的有效联合方案,可以有效地靶向T细胞耗竭和骨髓驱动的免疫抑制,并恢复T细胞对MM的免疫,从而获得更好的结局。相关联合治疗的临床试验正在进行中(表3)。
另一种可能逆转T细胞耗竭的选择为固定疗程治疗,如cevostamab。
检查点信号传导是骨髓瘤微环境中重要的免疫抑制成分,由于双抗有效激活T细胞而诱导B细胞上的检查点表达。由于促炎细胞因子的释放,检查点配体和受体如程序性死亡配体(PD-L1)和共抑制受体如T细胞免疫球蛋白和粘蛋白结构域-3(TIM-3)、淋巴细胞活化基因3(LAG-3)、杀伤细胞凝集素样受体G1(KLRG1)和具有免疫球蛋白和ITIM结构域的T细胞免疫受体(TIGIT)在骨髓瘤细胞中的表达上调。这反过来与T细胞上的程序性死亡受体(PD1)结合,导致T细胞能量不足、T细胞耗竭、细胞因子产生受损、靶细胞杀伤减少。与MGUS和健康供者浆细胞相比,MM细胞的PD-L1表达也增加。临床前研究表明FcRH5×CD3 双抗的抗骨髓瘤活性受到PD-1/PD-L1信号的限制,有效的PD-L1阻断可显著增强骨髓瘤细胞的消除。一项Ib期研究将进一步阐明该假设,其中联合PD-1单抗cetrelimab、特立妥单抗和talquetamab。图2总结了各种耐药机制和缓解这些耐药的潜在干预措施。
转向一线治疗
基于在RRMM中的良好结果,双抗也已转移到早期治疗;与重度经治和复发性难治性疾病相比,其T细胞健康度更好。由于免疫功能障碍为进行性,并受到疾病特征和治疗的影响,因此向一线治疗的转变有可能带来更好和持续的结局。比较诱导白血病后样本和复发/进展样本的 T细胞库显示,与后者相比,前者具有较高的早期记忆T细胞、较高的CD4/CD8 T细胞和更好的T细胞扩增,特别是如果患者既往接受<2线治疗。在一线使用免疫疗法(而非在复发时)得T细胞健康度更好,并且可以预测更好的结局。例如在MajesTEC-1研究中,既往接受过<3线治疗的患者的缓解率高于既往接受过3线+治疗的患者。另外值得注意的是,KarMMA-3和CARTITUDE-4研究将抗BCMA CAR-T细胞治疗转移到早期治疗线,发现PFS曲线仍未达到平台期。
有许多正在进行和即将进行的临床试验,在新诊断MM中评估多种双抗(单独或联合)联合其他药物,如表5所示。除了在一线中利用更好的T细胞环境外,这些组合还将评估其他药物如IMiD、抗CD38单抗和γ分泌酶抑制剂(Nirogacestat)在减轻各种耐药机制中的协同作用。
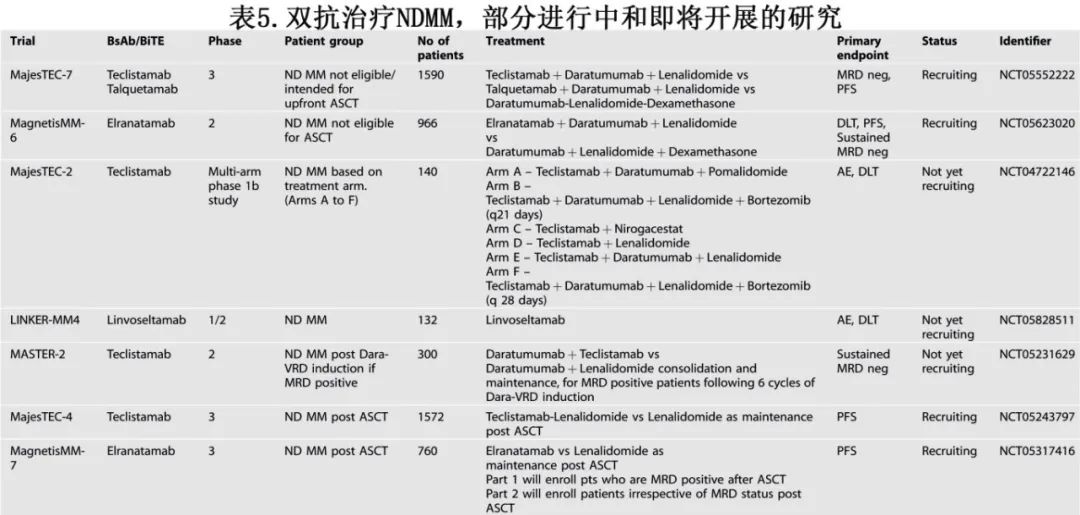
自体干细胞移植(ASCT)后Treg的抑制和CD8+ T细胞的恢复导致Treg/效应细胞比例降低,可能使免疫环境更支持使用双抗。两项3期研究(MajesTEC-4和MagnetisMM-7)正在招募患者,分别比较特立妥单抗+来那度胺和elranatamab单药与标准来那度胺作为 ASCT后巩固/维持治疗。
在MM前驱疾病阶段利用T细胞功能更好的其他尝试也正在进行中。随机2期Immuno-PRISM研究表明,在高危冒烟型骨髓瘤(SMM)患者中特立妥单抗显著优于来那度胺和地塞米松,ORR和MRD阴性率为100%,其中包括高危FISH患者CR。另一项2期概念验证研究 LINKER-SMM1也在招募高危SMM患者,以评估linvoseltamab的安全性、耐受性和有效性。2期LINKER-MGUS 1研究将开始招募患者,评估linvoseltamab在高危意义未明单克隆免疫球蛋白血症(MGUS)和非高危SMM中的安全性和有效性。
虽然双抗非常有效,但将其应用于新诊断和早期复发患者时仍存在一定挑战。靶向BCMA的双抗治疗RRMM可产生重度低丙种球蛋白血症和高重度感染率,包括多例感染性死亡。虽然在重度经治、现有有效治疗方案很少的人群中这是可以接受的,且MM本身的死亡风险高,但对于预期生存10年或更长时间的新诊断患者,可耐受的风险水平肯定有所不同。根据CAR-T研究的早期数据,早期治疗中这些毒性似乎较小。
与其他免疫疗法对比
尽管没有正面比较,但与抗体药物偶联物(ADC)和CAR-T细胞疗法等其他免疫疗法相比,双抗具有一定的优势。虽然CAR-T是一种一次性治疗,但与 CAR-T产品的4-6周制造时间相比,双抗的现成可用性为快速进展的患者提供更高的可用性和可靠性。CAR-T产品也容易受到不可预测的制备失败(10%)的影响,因此双抗是可靠的选择。CAR-T疗法的使用仅限于高度专业化的中心,这是另一个障碍。与CAR-T细胞疗法不同, 双抗在给药前不需要清淋。此外,与CAR-T相比,双抗具有较低的严重免疫相关副作用风险,如CRS、ICANS和迟发性神经毒性。CAR-T的3期研究显示,PFS曲线的初始显著下降可能与患者未能完成CAR-T输注有关,也突出了快速可靠地获得双抗的重要性。
belantamab mafodotin等抗BCMA ADC虽然可以像双抗一样现成获得,并且有效而不引起CRS/ICANS,但单药缓解率较低,并且受限于可显著影响生活质量的眼部毒性;导致频繁的给药中断和延迟,以及每次给药前严格的眼科评估带来额外负担。
其他治疗方式,包括针对两种骨髓瘤抗原或额外T细胞激活剂的三特异性抗体、结构修饰的双特异性抗体和NK细胞衔接器,都处于早期发展阶段,具有克服当代双抗一些局限性的潜力。
对T细胞定向疗法进行排序
各种免疫治疗模式和不同骨髓瘤抗原靶点的最佳排序尚未确定。在KarMMa和CARTITUDE研究的亚分析中显示,既往暴露于抗BCMA治疗(ADC或双抗)的患者对BCMA CAR-T产品的反应较差。另一方面,抗BCMA CAR-T细胞治疗失败后,抗BMCA 双抗治疗显示出良好反应率,尽管 PFS仍很短。但改变靶点可能更有效,抗BMCA治疗后使用非BCMA 双抗(如talquetamab和cevostamab)已显示出疗效,但反应持续时间不佳。尽管取得了这些令人兴奋的结果,但仍有许多问题有待解答,例如,对既往双抗原发难治患者基于不同双抗的疗效,以及T细胞治疗和其他干预治疗之间时间间隔的影响尚不清楚。
未来看法
由于其令人印象深刻的疗效,双抗目前已进入复发多发性骨髓瘤的常规临床实践,但这仅仅标志着骨髓瘤治疗范式转变的开始。目前正在探索许多途径来提高其疗效和安全性,包括在患者治疗过程中更早地使用双抗、合理组合以对抗耐药机制、优化给药计划(包括有限期治疗)及个性化支持治疗以预防并发症。正在进行和即将进行的研究的结果以及真实世界数据将揭示双抗在多发性骨髓瘤中的真正潜力。
总结点
●双抗在重度经治多发性骨髓瘤患者中显示出非常高的缓解率和持久缓解。
●双抗正在早期治疗中进行研究,彼时患者拥有更健康的T细胞谱。
●双抗与其他药物联合治疗可减轻耐药机制并改善疗效结局。
●感染是重大挑战,但预防性使用免疫球蛋白、预防性抗菌药物、疫苗和生长因子可显著降低风险。
●关于这些药物与其他免疫治疗的最佳排序,仍需要更多数据。
参考文献
Devasia, A.J., Chari, A. & Lancman, G. Bispecific antibodies in the treatment of multiple myeloma. Blood Cancer J. 14, 158 (2024). https://doi.org/10.1038/s41408-024-01139-y


