JCO:深度学习AI模型利用病理组织切片预测乳腺癌和卵巢癌中的HRD及铂类药物治疗反应
时间:2024-08-23 16:00:46 热度:37.1℃ 作者:网络
导读
乳腺癌、卵巢癌的机制研究和临床试验共同表明,携带同源重组缺陷(HRD)的患者可从铂类药物和PARP抑制剂治疗中获益。目前,美国食品药品监督管理局(FDA)已批准两种用于卵巢癌和乳腺癌患者的HRD伴随诊断(CDx)检测方法,即Myriad myChoice CDx和FoundationOne CDx;其通过量化基因组不稳定性,并结合BRCA 1/2状态来确定HRD。
临床上现有检测HRD的所有方法均依赖于分子分析,这导致临床工作流程延长,耗费的时间、成本较高,并阻碍了分子诊断在标准治疗和临床试验中的广泛应用。在全球临床实践中,对苏木精和伊红(H&E)染色后的组织进行光学显微镜形态学检查成为肿瘤活检的常规处理手段,并可用于实体瘤诊断。近年来,人工智能(AI)方法层出不穷,其能够从H&E染色的组织病理学切片的数字图像中预测基因组变化,并逐渐成为改变癌症诊断和临床治疗的方式方法
近日,美国加州大学圣地亚哥分校的研究团队在Journal of Clinical Oncology杂志发表了题为“Deep Learning Artificial Intelligence Predicts Homologous Recombination Deficiency and Platinum Response From Histologic Slides”的文章。研究团队介绍了一种基于深度学习的AI分类器DeepHRD,可直接从乳腺癌和卵巢癌数字化H&E染色切片中检测HRD。研究团队使用来自癌症基因组图谱(TCGA)项目的数据对DeepHRD进行训练和验证,并证明其使用外部数据集检测HRD的能力。此外,多个独立患者队列的分析结果证明,DeepHRD能够检测到比当前分子检测更多的HRD患者,且其预测的HRD样本对铂类药物治疗具有更好的完全缓解(CR)和生存结果。

文章发表在Journal of Clinical Oncology
主要研究内容
研究团队开发一种弱监督卷积神经网络架构DeepHRD,可预测基因组HRD以及通过H&E切片全切片图像(WSI)预测 HRD状态;从TCGA中筛选出1008例原发性乳腺癌的快速冷冻(FF)切片数据和1,055例乳腺癌的福尔马林固定石蜡包埋(FFPE)切片数据以训练DeepHRD乳腺癌模型,其中70%用于训练,15%用于调整训练参数,剩余15%用于测试最终模型。在训练前,平衡每个乳腺癌PAM50分子亚型30的HRD和HRP样本的数量,以防止学习亚型特异性的组织学特征;最终训练出两个独立的模型,一个用于FF,一个用于FFPE组织载玻片。
重要的是,上述模型是独立于保留的测试集进行训练的,即训练和测试队列中没有患者重叠;每个模型允许使用单张数字切片进行患者级别的预测。具体而言,DeepHRD可以预测癌症是HRD还是同源重组修复完整(HRP),其在数字切片上覆盖了一个概率掩码,从而允许后续的组织病理学研究。
研究团队将DeepHRD的乳腺癌FF模型应用于保留的TCGA样本(n = 414)中,发现AUC为0.81;当将乳腺癌FFPE模型应用于保留的TCGA样本(n = 406)时,观察到相同的AUC值,其性能与乳腺癌FF模型相当。随后,研究团队在CPTAC(n = 116)和METABRIC(n = 156)两个独立队列对乳腺癌FF模型进行外部验证,得到的AUC为0.76,这进一步证实了FF模型的普遍适用性。
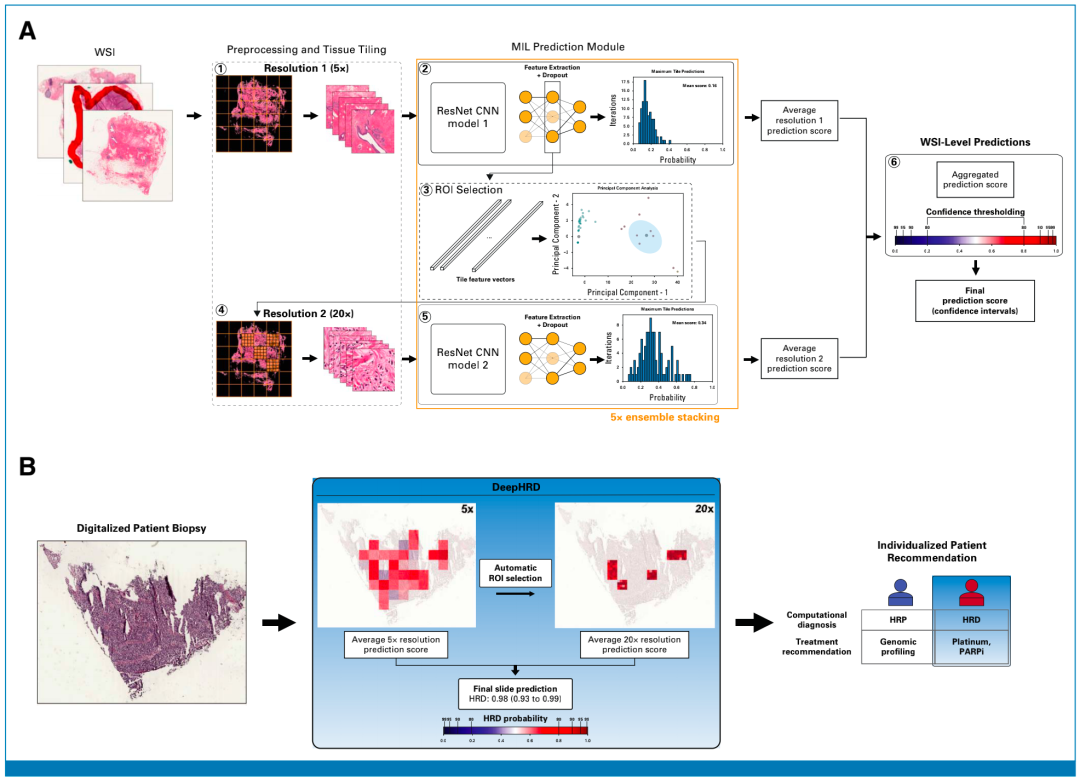
图1. 基于多分辨率卷积神经网络架构的组织病理组织玻片的HRD检测
接下来,研究团队将DeepHRD乳腺癌FFPE模型应用于一个外部的铂类药物治疗的转移性乳腺癌(MBC)队列中,该队列共77名患者,均具有全外显子组测序(WES)数据和数字H&E WSI,其中54名患者首先接受了紫杉类药物治疗。结果显示,HRD和同源重组修复完整(HRP)患者的中位无进展生存期(PFS)分别为14.4个月和3.9个月,增加了3.7倍;调整分子亚型和诊断年龄后的风险比(HR)为0.45。特别地,DeepHRD还能够检测出CR与仅部分缓解或无反应的癌症,AUC为0.76。
与DeepHRD相比,基于BRCA 1/2突变、不同阈值基因组衍生的HRD评分或基于SBS3突变的分层评估未显示PFS的显著差异。值得注意的是,TCGA和MBC组织切片使用不同的扫描仪进行数字化,这也进一步证明了DeepHRD的通用性。此外,在三个乳腺癌队列中,DeepHRD预测的HRD状态与非铂类药物治疗结果无显著差异。
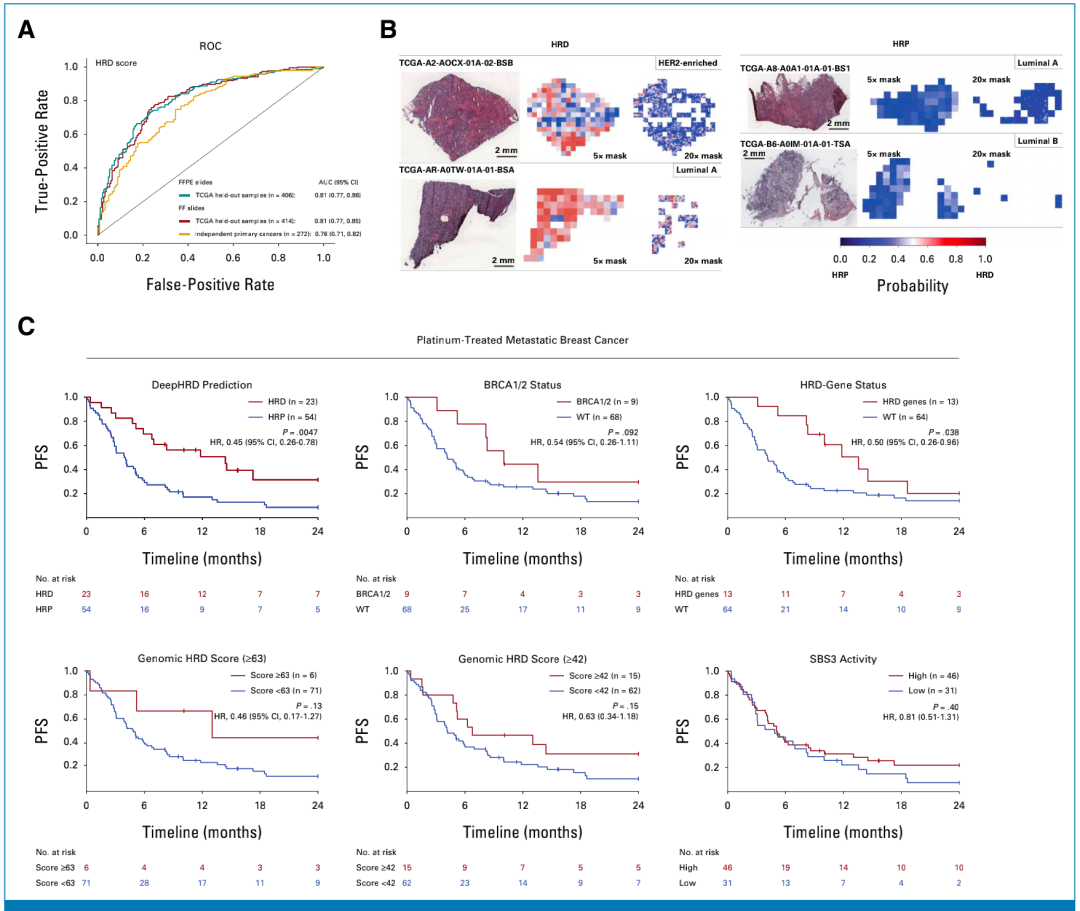
图2. DeepHRD预测原发性和转移性乳腺癌中HRD和铂类治疗的PFS
为评估DeepHRD能否用于卵巢癌,研究团队使用乳腺癌FF模型产生的预训练权重和偏差,对来自TCGA的459例高级别浆液性卵巢癌(HGSOC)FF样本进行迁移学习,训练了一个独立的卵巢癌FF模型。
为评估DeepHRD卵巢癌FF模型区分铂类药物治疗获益个体的能力,研究团队将该模型应用于66例初次手术后接受一线铂类药物治疗的患者TCGA HGSOC样本中。结果显示,在调整肿瘤分期和诊断年龄后,预测为HRD和HRP的患者的中位生存期(mOS)分别为4.6年和3.2年。同样地,基于BRCA1/2、基因组HRD评分或SBS3突变的分层未显示出显著的总生存(OS)期差异。此外,以HRD评分≥63进行分层可显示显著的OS差异,但其仅注释了DeepHRD检测到的HRD患者的一半。
随后,研究团队将DeepHRD卵巢癌FF模型应用于外部真实世界的铂类药物治疗NACT-IDS队列中。根据DeepHRD的预测,可将这些患者分类为HRD或HRP, 3年OS概率分别为70.3%和50.2%,调整分期和诊断年龄后的HR为0.49。与使用扩展的HRD相关基因组突变相比,DeepHRD分类出的HRD患者多3.1倍。在真实世界队列中,BRCA1/2基因突变和SBS3突变的存在都不会导致显著的OS差异。
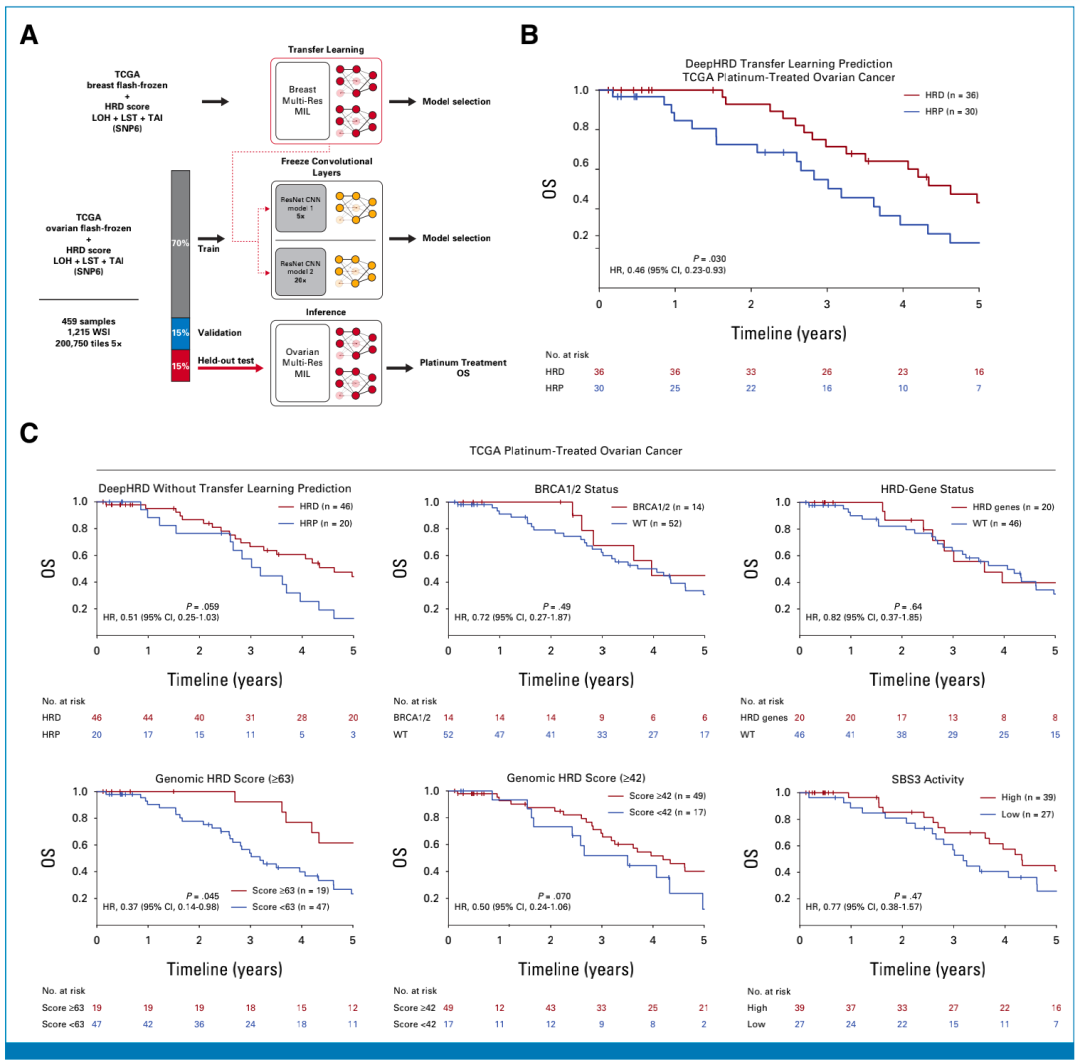
图3. DeepHRD的迁移学习预测铂治疗TCGA卵巢癌患者的OS
结 语
综上所述,DeepHRD可跨越多个外部队列、切片扫描仪和组织固定变量,直接从常规H&E切片预测乳腺癌和卵巢癌中的HRD。与现有标准分子测试相比,DeepHRD将HRD患者的分类数量增加了1.8-3.1倍,并能更好地预测CR和PFS,特别是捕捉到了更多对铂类药物治疗有反应的BRCA1/2野生型肿瘤;这些结果证实了DeepHRD的稳健性和可推广性。综上,该研究提示根据数字H&E切片在临床诊断中部署AI指导是切实可行的,并可推广到各种癌症类型中,这为现有的分子HRD检测提供了一种经济有效且及时的补充,能够比标准基因测序更快、更准确、更便宜地完成这项工作。
文章通讯作者、io9(一家开发精准肿瘤学AI平台的软件公司)联合创始人、首席科学官Ludmil B. Alexandrov博士说道:“精准医学已经改变了癌症患者的预后,但由于成本昂贵、耗时较长,许多有资格接受精准治疗的晚期癌症患者并未得到正确的一线治疗。这项研究证明了DeepHRD能够从常规病理切片中预测乳腺癌和卵巢癌的HRD,希望该深度学习AI平台能够尽快应用于临床领域,为癌症患者及家属带来真正的改变。”
io9首席执行官Greg Hamilton表示:“基于同一份病理报告,DeepHRD可准确预测患者在此阶段是HRD阳性还是阴性,从而帮助肿瘤科医生开始制定个性化治疗策略。在诊断的同时获得生物标志物信息的概念将使许多人受益,能够让患者迅速得到正确的一线治疗。”
论文原文:
Bergstrom et al., Deep Learning Artificial Intelligence Predicts Homologous Recombination Deficiency and Platinum Response From Histologic Slides. J Clin Oncol (2024).
https://ascopubs.org/doi/10.1200/JCO.23.02641


