ATVB 蔡哲钧/宋伸/宋江平/杨劲合作利用单细胞转录组测序解析小鼠腹主动脉瘤中免疫细胞的多样性和动态变化
时间:2024-08-11 06:00:23 热度:37.1℃ 作者:网络
腹主动脉瘤(AAA)被定义为腹主动脉肾下段的永久性扩张,动脉瘤破裂有着极高的死亡率。AAA的发病机制是多因素的,包括血管平滑肌细胞凋亡、外膜中细胞外基质降解,以及主动脉壁内炎症细胞浸润。在动脉瘤形成和扩展过程中,免疫细胞起着至关重要的作用。例如,巨噬细胞在组织损伤早期和炎症性主动脉微环境的形成中不可替代,抑制巨噬细胞浸润可以减轻AAA小鼠模型中的主动脉壁破坏和动脉瘤扩张。这些发现表明,明确AAA组织中炎症细胞的分布和变化具有重要意义。
2024年7月19日,浙江大学蔡哲钧、阜外医院宋伸、宋江平及杭州师范大学杨劲等团队在Arteriosclerosis, Thrombosis, and Vascular Biology上发表了题为“Single-cell RNA Sequencing Deconstructs the Distribution of Immune Cells within Abdominal Aortic Aneurysms in Mice”的研究论文,分别描述了每种炎症细胞类型对AAA发展的影响,并研究了它们在疾病进程中的关系。这将有助于未来发现AAA诊断和治疗的新靶点。

首先,研究者们通过对小鼠腹主动脉瘤(AAA)模型中的免疫细胞进行单细胞转录组分析,识别出七种不同的免疫细胞亚型。小鼠模型在术后7天或14天取样,并通过Seurat包进行多步分析,区分出26个亚群,进一步整合为9个细胞簇。研究发现AAA组中CD45阳性免疫细胞显著增加,尤其是单核细胞/巨噬细胞、树突状细胞和中性粒细胞。为了区分组间的基因表达差异,研究人员在免疫细胞中鉴定了几种特异性表达的基因,并在特征图和小提琴图中展示了这些基因的表达情况。利用RNA速度分析,研究人员有效地绘制了AAA组织中免疫细胞的发育轨迹,并通过SCENIC分析揭示了不同时间点的细胞群体中关键调控因子的活动情况。结合这些参数与调控因子特异性评分,研究突出了几个关键调控因子在特定细胞群中的重要作用(图1)。
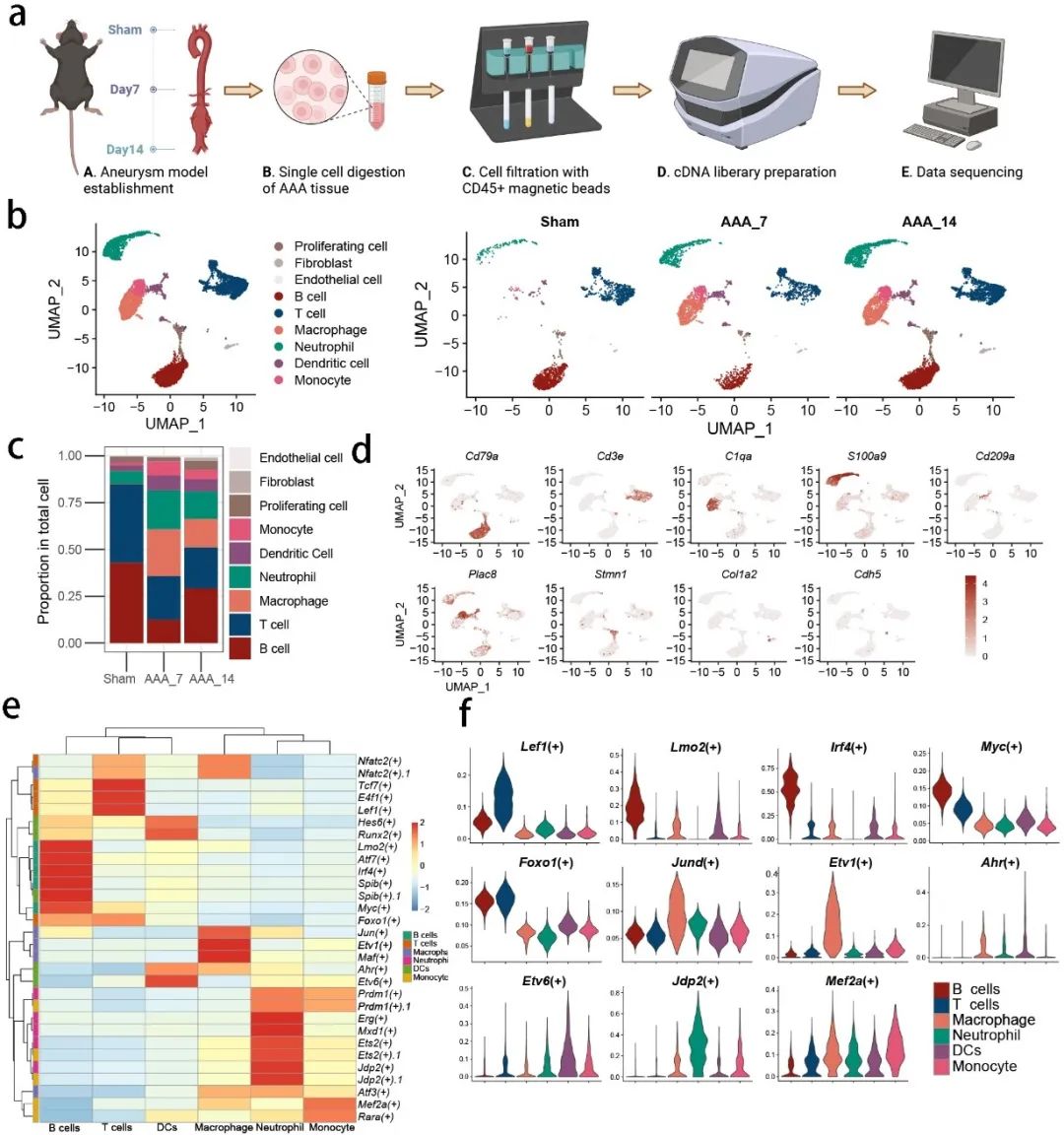
图1. 七种CD45+细胞群得以从小鼠腹主动脉瘤组织分离并进行分析
深入研究炎症细胞在AAA发病机制中的作用时,研究人员过滤了集成数据集中的免疫细胞,并利用特定的细胞表面标志物对这些细胞进行分类。结果表明,与正常主动脉相比,AAA组的单核细胞显著浸润,通过基因表达热图展示了这些亚群的特征。研究进一步鉴定了五种不同的巨噬细胞亚群,并分析了它们在AAA微环境中的生物学行为(图2)。
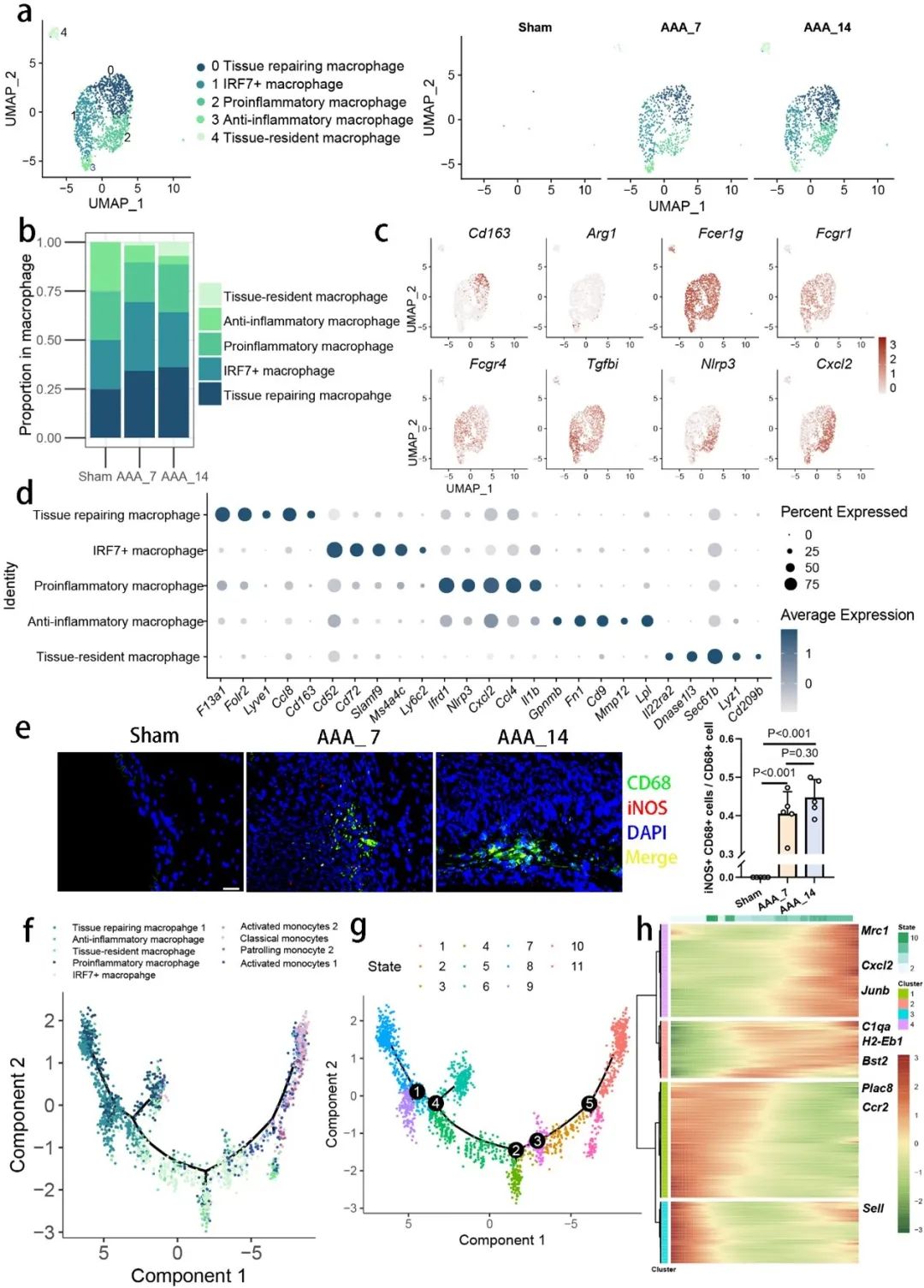
图2. 单核细胞/巨噬细胞谱系在腹主动脉瘤和假手术主动脉样本之间表现出异质性
T细胞在AAA组织中表现出显著的异质性,研究人员分离并注释了10种T细胞亚型。研究显示,AAA中的T细胞主要包括Naive CD4+、辅助T细胞、调节性T细胞和Th17细胞等亚型。通过流式细胞术验证了在第7天,活化的CD4+ T细胞比例高于第14天(图3)。
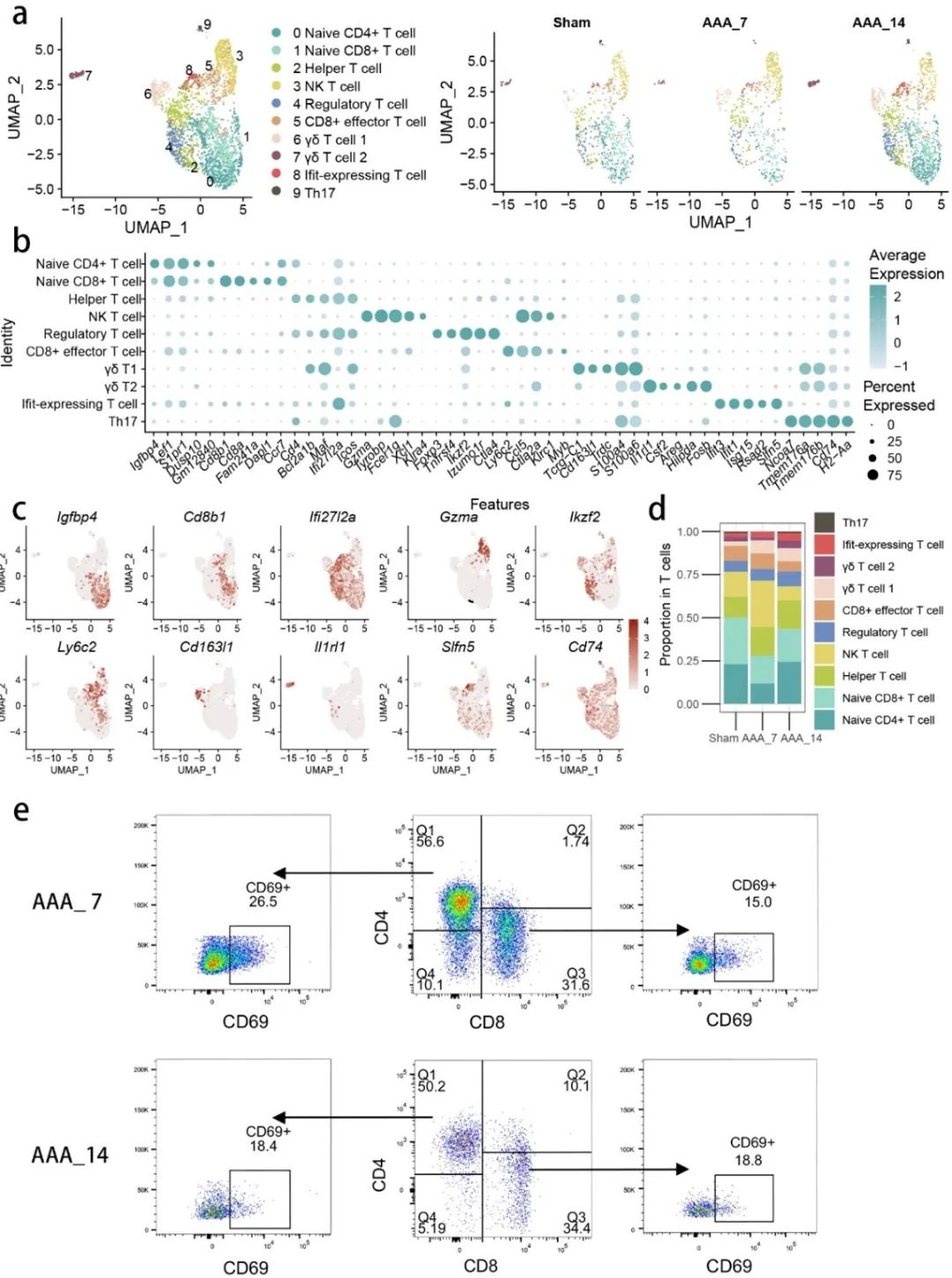
图3. 腹主动脉瘤引起活化CD4+和CD8+ T细胞的扩增
树突状细胞(DCs)在AAA和对照组之间也存在显著差异。研究鉴定了五种不同的DC亚群,其中cDC1亚群在AAA中的比例显著增加。这些亚群在AAA形成后迅速扩展,并在微环境中发挥重要作用,参与免疫应答和炎症反应(图4)。
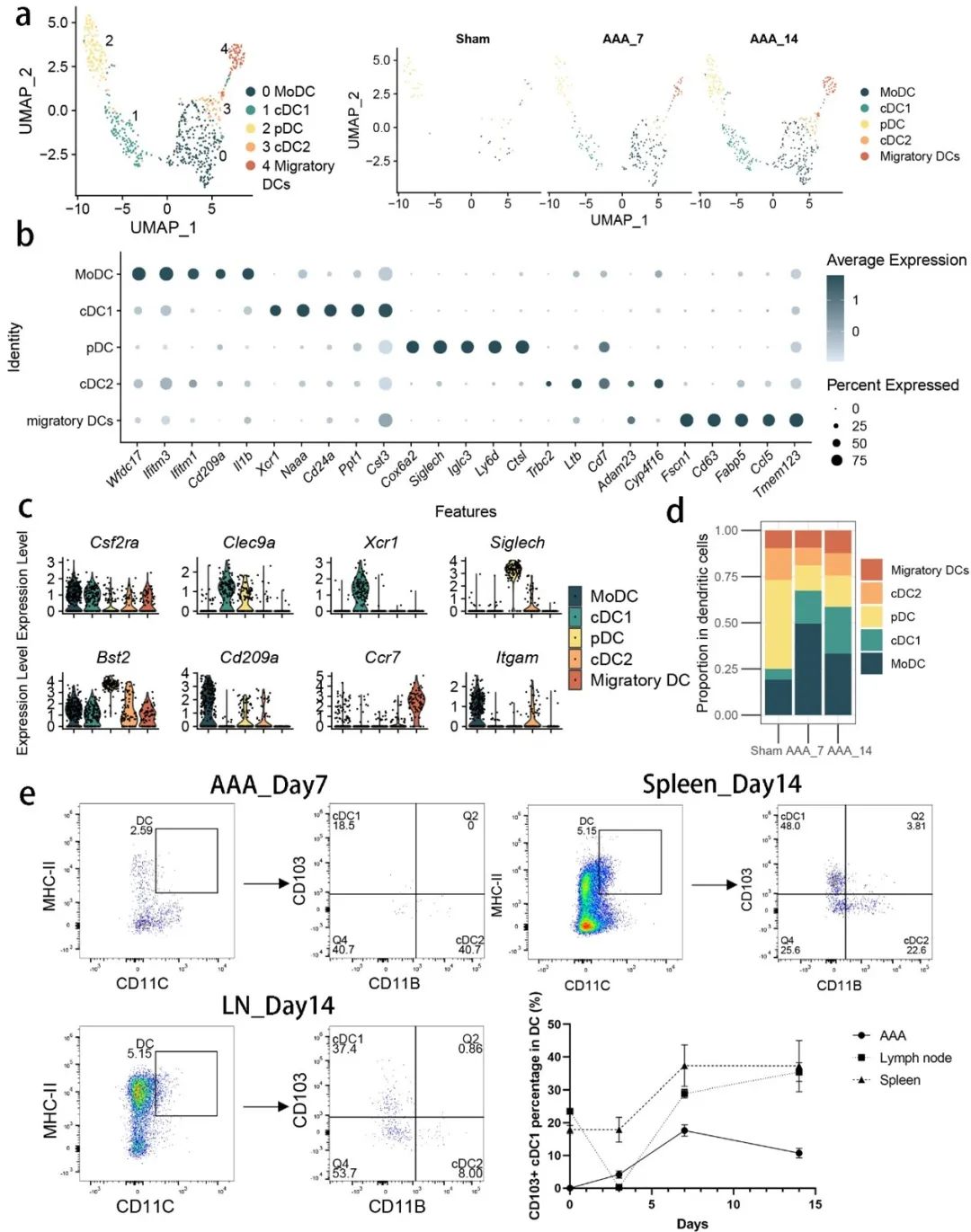
图4. 腹主动脉瘤组织与假手术组织之间的树突状细胞亚型差异
研究还鉴定了参与AAA病理过程的其他免疫细胞亚型,如中性粒细胞和B细胞。通过消除污染和低质量细胞,研究人员分离出了五种不同的中性粒细胞亚群,并分析了它们的发展轨迹和差异表达基因。结果显示,中性粒细胞在AAA中的发育过程具有显著的分阶段特征(图5, 图6)。
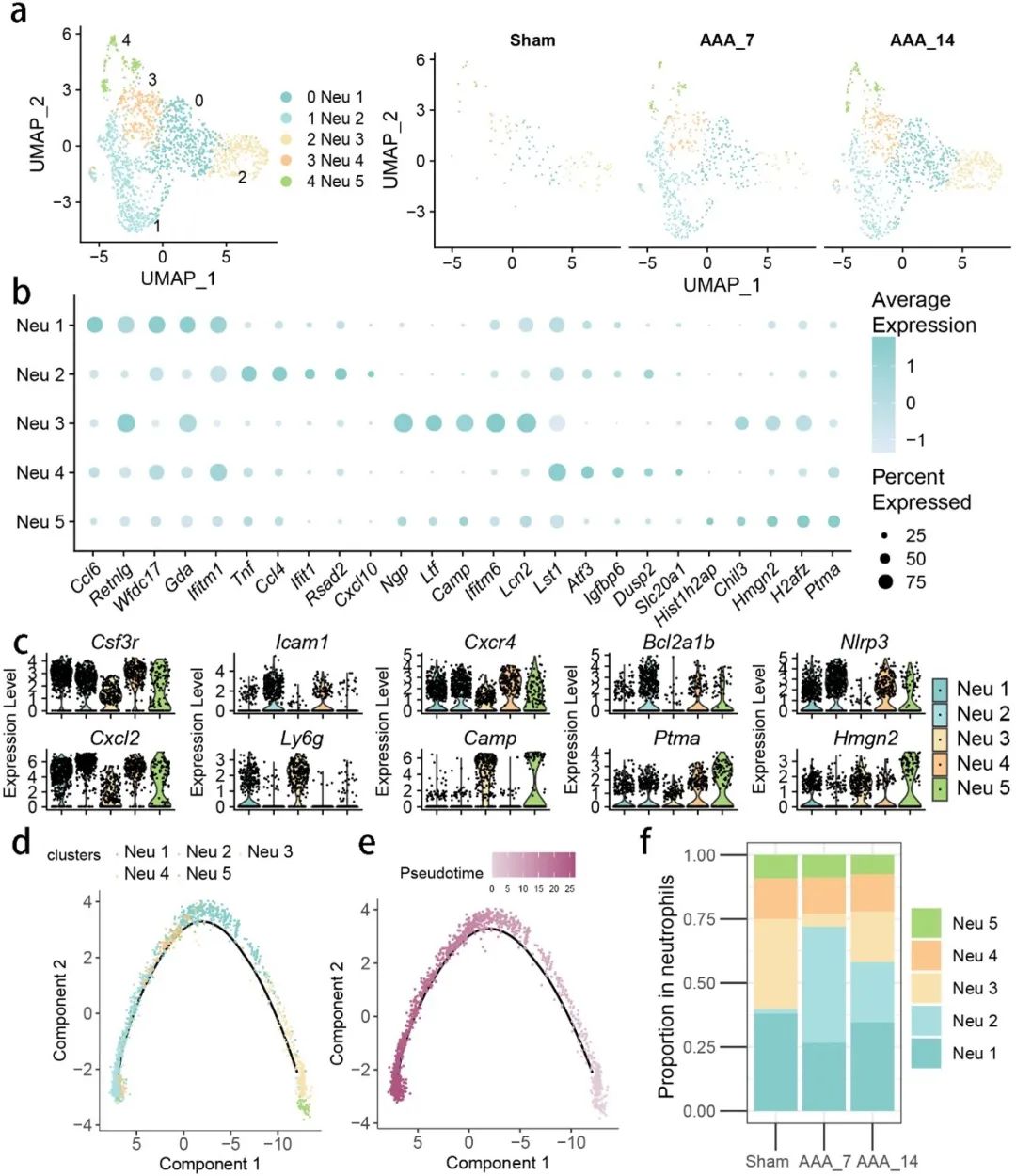
图5. 在弹性蛋白酶诱导后,腹主动脉组织中的中性粒细胞簇发生变化
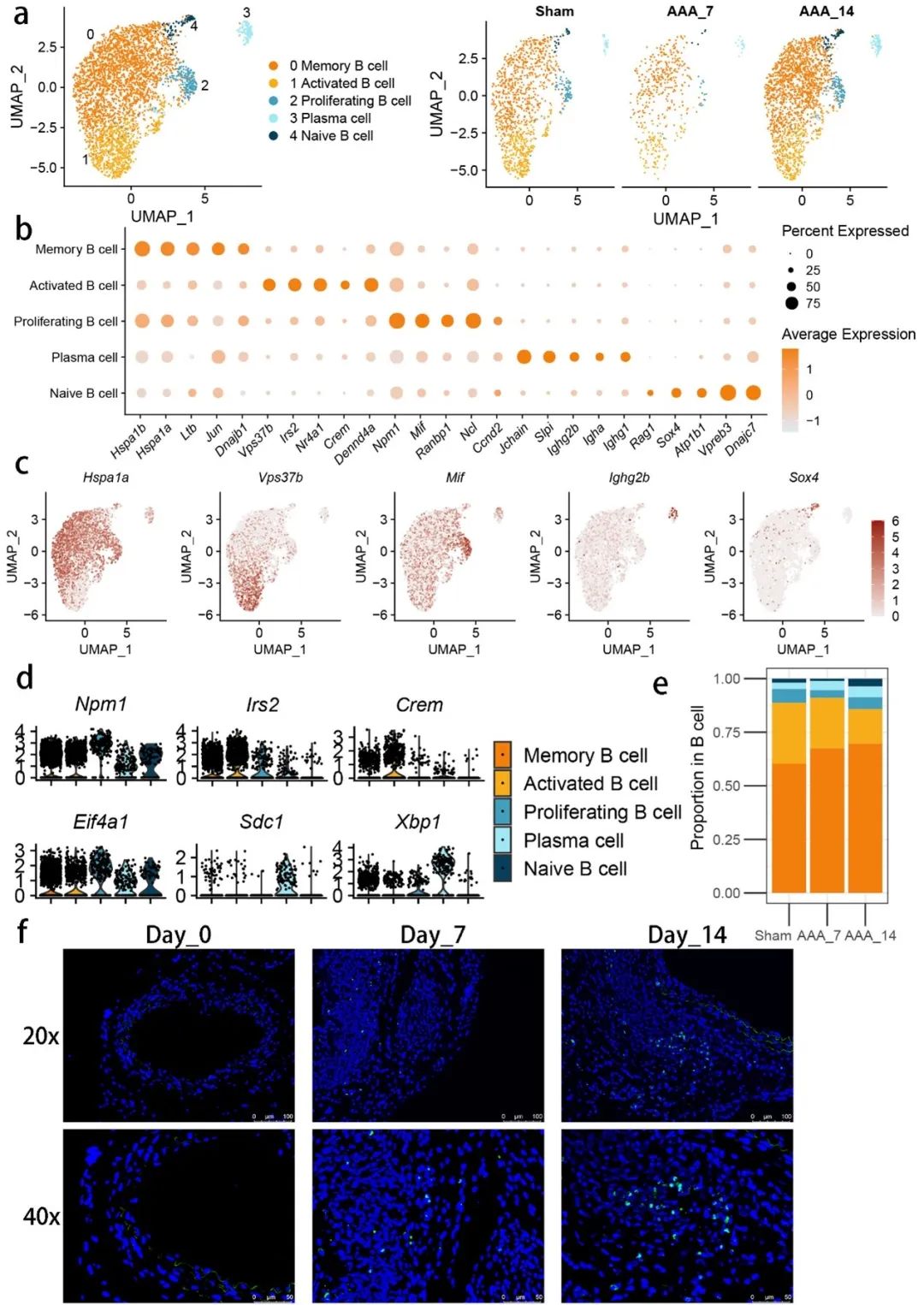
图6. 腹主动脉瘤相关的炎症将4种不同的B细胞亚群招募到微环境中
为了揭示炎症细胞之间的调控路径,研究人员应用CellChat分析,对小鼠单细胞测序数据进行分析,确定了不同时间点AAA组织中的细胞间相互作用。结果表明,炎症细胞在AAA诱导后的相互作用不断增加。通过多重免疫组化验证了人类动脉瘤组织中的相似发现,进一步支持了这些免疫细胞在AAA发病机制中的重要作用(图7)。
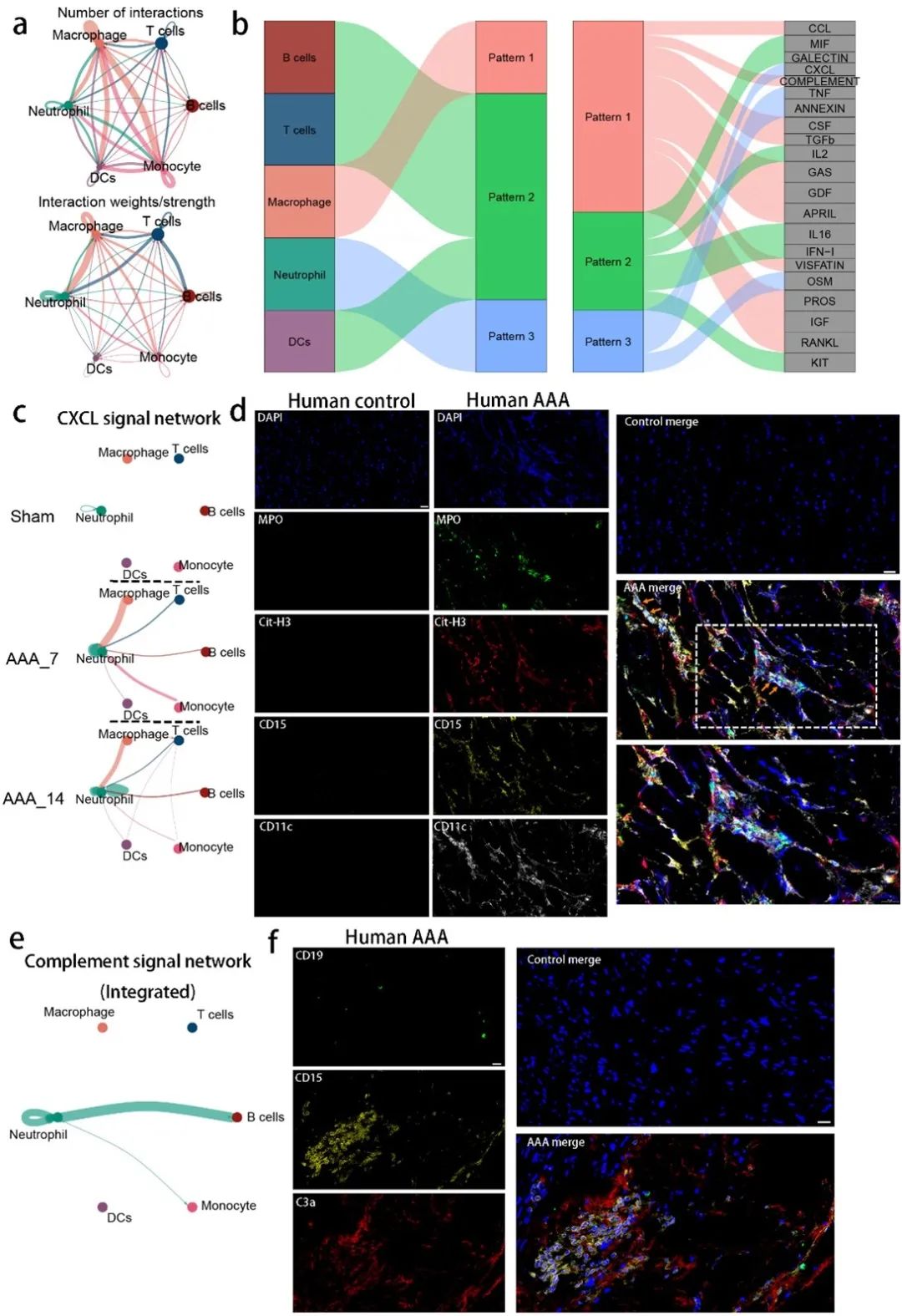
图7. CellChat分析鉴定了腹主动脉瘤中的免疫细胞相互作用通路
综上所述,该研究通过单细胞转录组分析,深入解析了小鼠腹主动脉瘤中免疫细胞的多样性和动态变化。研究揭示了七种不同的免疫细胞亚型,并阐明了它们在AAA病理过程中的关键作用。巨噬细胞和T细胞在AAA中的显著扩展和功能异质性,为理解AAA的发病机制提供了新的视角。通过SCENIC和CellChat等分析工具,研究还揭示了调控因子网络和细胞间相互作用,为AAA的潜在治疗策略提供了新的研究方向。这些发现不仅增强了对AAA免疫环境的理解,也为未来的临床干预提供了宝贵的参考。
浙江大学医学院附属第二医院心内科袁振博士为本文第一作者。浙江大学医学院附属第二医院蔡哲钧教授、中国医学科学院阜外医院宋伸、宋江平教授及杭州市第二医院杨劲教授为本文共同通讯作者。上述工作得到了国家自然科学基金面上项目、中国医学科学院医学科学创新基金研发计划的资助。
原文链接:
https://www.ahajournals.org/doi/10.1161/ATVBAHA.124.321129


