【Leukemia】安刚/邱录贵团队首次探究骨髓正常浆细胞在多发性骨髓瘤的临床价值
时间:2024-08-05 15:01:44 热度:37.1℃ 作者:网络
正常浆细胞
多发性骨髓瘤(MM)是一种以骨髓异常浆细胞恶性增殖为特征的高度异质性血液系统恶性肿瘤,目前仍不可治愈。骨髓中正常浆细胞(NPC)与异常浆细胞常互相竞争克隆优势,在浆细胞疾病的恶性转化和疾病侵袭性中发挥重要作用。在治疗后微小残留病(MRD)阶段,NPC数量或比例变化或可反映缓解深度的变化和骨髓微环境的改变。
2024年8月2日,中国医学科学院血液病医院(中国医学科学院血液学研究所)安刚/邱录贵团队在《Leukemia》(IF=12.8)在线发布了题为“Clinical implications of residual normal plasma cellswithin bone marrow acrossvarious disease stages in multiple myeloma”的研究论文。该研究依托于中国首个前瞻纵向血液病队列,首次探究骨髓残存NPC在MM不同疾病阶段的临床价值,并提出以NPC为基础的MRD动态分层新体系。
中国医学科学院血液病医院(中国医学科学院血液学研究所)安刚主任医师、郝牧研究员和邱录贵主任医师为共同通讯作者,博士研究生严文强和史丽慧主治医师为共同第一作者。该项目获得国家自然科学基金和中国医学科学院医学与健康科技创新工程等的支持。

研究结果
整个队列的临床特征和治疗
该研究共纳入来自中国医学科学院血液病医院(中国医学科学院血液学研究所)前瞻纵向血液病队列-多发性骨髓瘤(NICHE-MM)子队列中的1363例MM患者和近5000份序贯骨髓流式数据。患者中位年龄59岁,男性770例(56.5%),ISS III期和R-ISS III期分别占44.2%和21.2%。大多数患者(89.1%)接受新药治疗(蛋白酶体抑制剂和/或免疫调节剂)作为一线治疗,28.2%接受了ASCT。中位随访时间为49.0个月,失访率为7.8%,中位PFS (mPFS)和中位OS (mOS)分别为42.3个月和71.6个月。
诊断时高NPC比例(≥5%)预示预后良好
1055例患者在诊断时具有流式结果,骨髓成核细胞(BMNC)内总PC的中位数比例为5.05%,NPC比例≥5%定义为高NPC,NPC比例<5%定义为低NPC,47例(4.5%)为高NPC (≥5%)组。高NPC (≥5%)和低NPC (<5%)组的临床特征及治疗见表1。
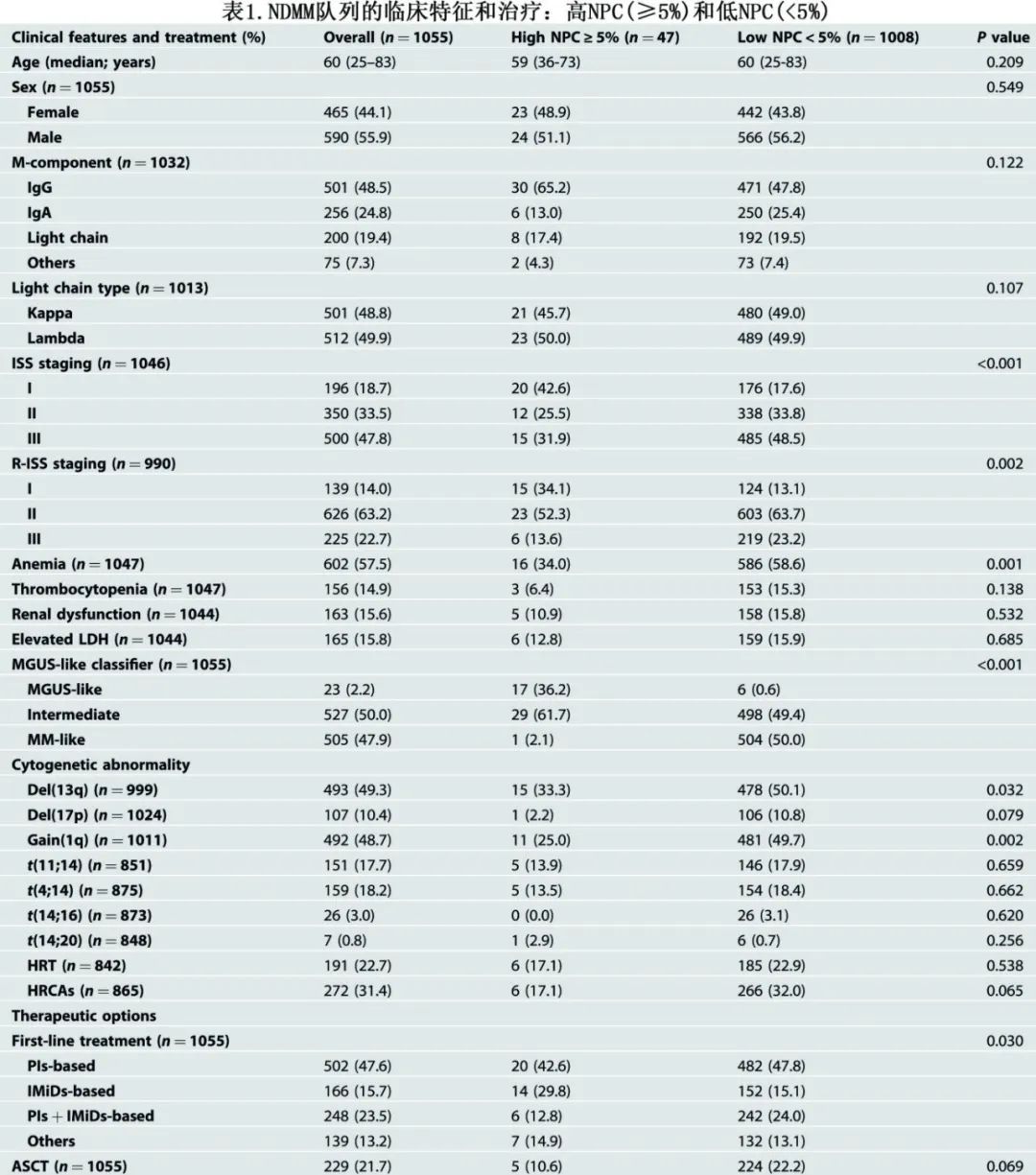
生存结局方面,高NPC患者的mPFS优于其他患者(68.1个月vs 37.8个月,P<0.001;图1A),mOS同样如此(未达到vs 66.4个月,P=0.009;图1B)。高NPC对预后的有利影响与ISS分期、LDH水平、HRCA和治疗方案无关(mPFS: HR=0.330,P<0.001;mOS: HR=0.417,P=0.016)。高NPC患者中也观察到较高的多克隆IgM水平 (P<0.001;图1C)。在未受累IgA/IgG水平中也可发现类似结果。此外,低NPC组与高NPC组相比,一种或多种未受累免疫球蛋白的免疫麻痹更为常见(92.2% vs. 60.9%;P<0.001),而两种或两种以上未受累免疫球蛋白的免疫麻痹发生率相似(78.9% vs 39.1%;P<0.001;图1D)。
首次复发时高NPC(≥5%)预示良好的第二次生存期
在327例首次复发的患者中,83.8%的患者接受蛋白酶体抑制剂为基础治疗、34.3%的患者接受ASCT作为一线治疗。骨髓浆细胞(BMPC)中位数为6.51%,74例(22.6%)患者NPC比例≥5%,也定义为高NPC组。与低NPC组相比,高NPC组出现ISS III期的比例较低(32.9% vs 50.6%;P=0.007),但复发时高NPC组贫血或HRCA没有明显减少(P>0.05)。重要的是,与高NPC组相比,低NPC组在12个月内早期复发的频率更高(23.7% vs 12.2%;P=0.035)。复发时高NPC与复发后第2次mPFS的显著改善相关,低NPC组为13.9个月、高NPC组为20.4个月(P=0.038;图1e);同样,复发时高NPC与第2次mOS较优密切相关,分别为20.2个月和33.6个月(P=0.002;图1f)。在2018年前的队列中,首次复发时高NPC对预后的有利影响非常相似,但在2018年后的队列中观察到的结果并不显著。与上述发现相似,在复发时高NPC的患者中,也观察到较高的IgM水平和较低的免疫麻痹率(图1G、H)。
MRD节点NPC检查最佳时间点的确定
然后作者评估了MRD节点NPC的临床意义。在919例(67.4%)至少3次MRD的患者中,478例(48.2%)达到MRD阴性状态,153例(32.0%)为NGF-MRD阴性(1×10-5)。由于MRD是一个动态监测的变量,因此从多个连续MRD来源中选择可检测MRD患者相应肿瘤负荷最低的时间点,以及MRD阴性队列中第一个MRD不可检测的时间点,代表一线治疗中最佳缓解状态,以供进一步研究。正如预期一致,当基于最低肿瘤负荷分组时,发现残余MRD水平较低患者mPFS有所改善 (P<0.001);mOS患者也观察到类似的显著改善(P<0.001)。
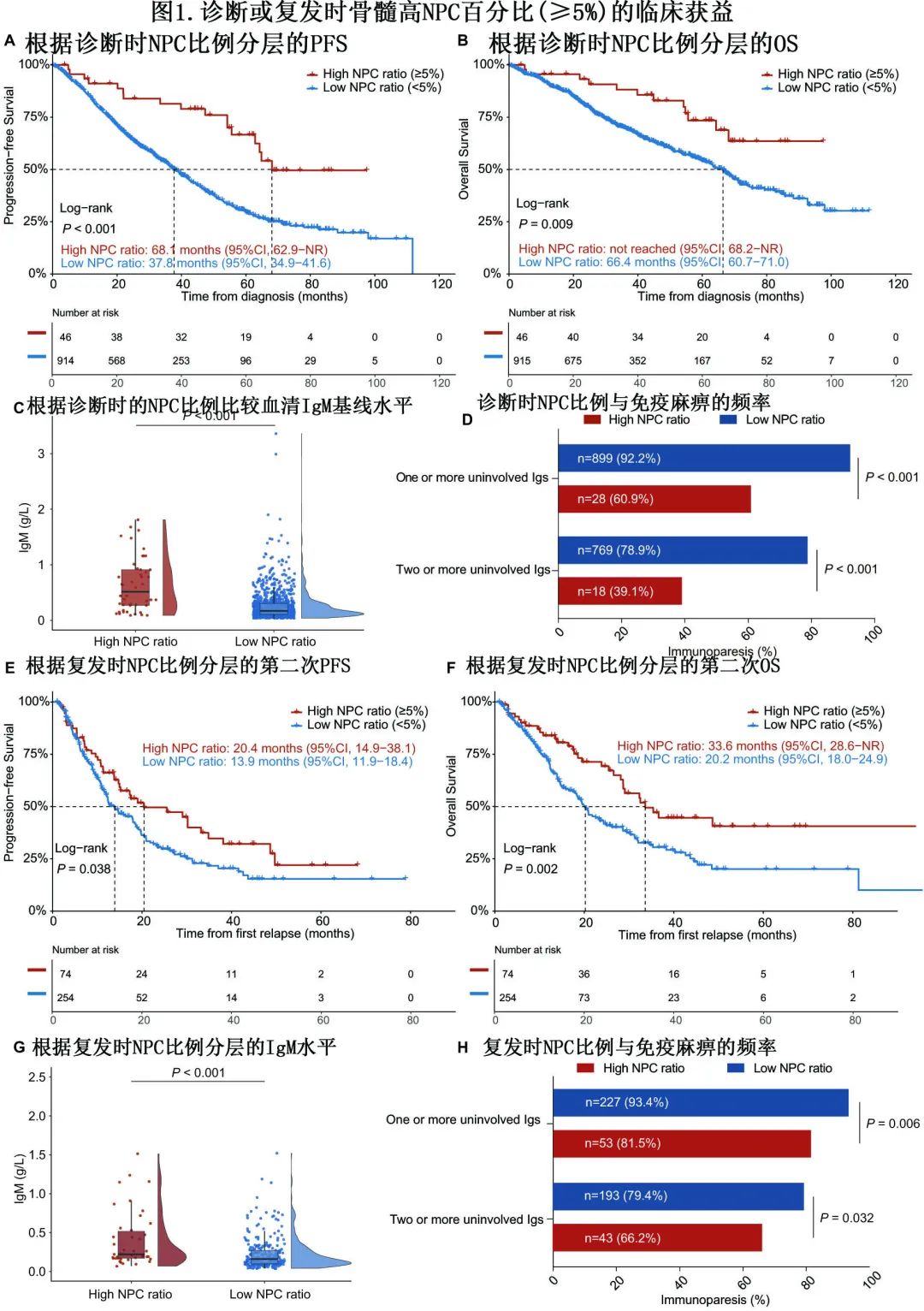
高NPC表明MRD阴性节点的生存获益和免疫重建
首先集中研究了MFC/ NGF-MRD阴性患者NPC的临床意义(n=478)。由于肿瘤细胞低于检测限,因此BMPC中残存的NPC比例变得无关紧要。因此将注意力转移到BMNC中的NPC比例。线性相关分析证实NPC比例与mPFS (R=0.17, P<0.001;图2A)和mOS (R=0.15, P=0.001;图2B)均呈显著正相关。尽管由于随访时间不成熟导致相关系数相对较低,但仍可观察到在较低的NPC比例患者中发生更多的疾病进展或死亡事件。接下来,利用surv_cutpoint函数确定NPC比例预测mPFS或mOS的最佳cutoff值为0.22%(图2C)。因此将MRD阴性患者分为两组:高NPC比例(≥0.22%;n=119, 24.9%),低NPC比例(<0.22%;N=359,75.1%)。正如预期,在所有MRD阴性队列中,高NPC比例与mPFS和mOS的有利延长显著相关(P<0.001, P=0.002)。且从第一个MRD时间时间点开始的界标分析显示出显著一致性。
随后该结果在基于不同MRD方法的亚组中也得到验证。在MFC-MRD阴性队列中,80例(24.6%)患者为高NPC比例,高NPC比例组患者的mPFS明显长于低NPC比例组(85.0 vs 49.9个月,P<0.001;图2E)。同样,高NPC比例组的mOS也比低NPC比例组更佳(未达到vs. 84.3个月,P=0.006;图2F)。在NGF-MRD阴性患者中,高NPC比例患者的mPFS和mOS预后同样显著良好,但由于随访时间不成熟,未达到统计学意义(mPFS: P=0.053;mOS: P=0.218;图2E、F)。同时,MRD阴性状态下较低的NPC比例与较高的MRD复发/疾病进展风险相关(HR=1.46,P=0.030;图2G)。
MRD阴性节点的NPC比例与IgG (R=0.47, P<0.001)、IgA (R=0.56, P<0.001)、IgM (R=0.36, P<0.001)呈正相关)。高NPC比例患者治疗后IgG、IgA和IgM正常的频率明显更高(P<0.001;图2H)。与低NPC比例组相比,高NPC比例组总体免疫重建更为频繁(37.4% vs 13.8%,P<0.001)。
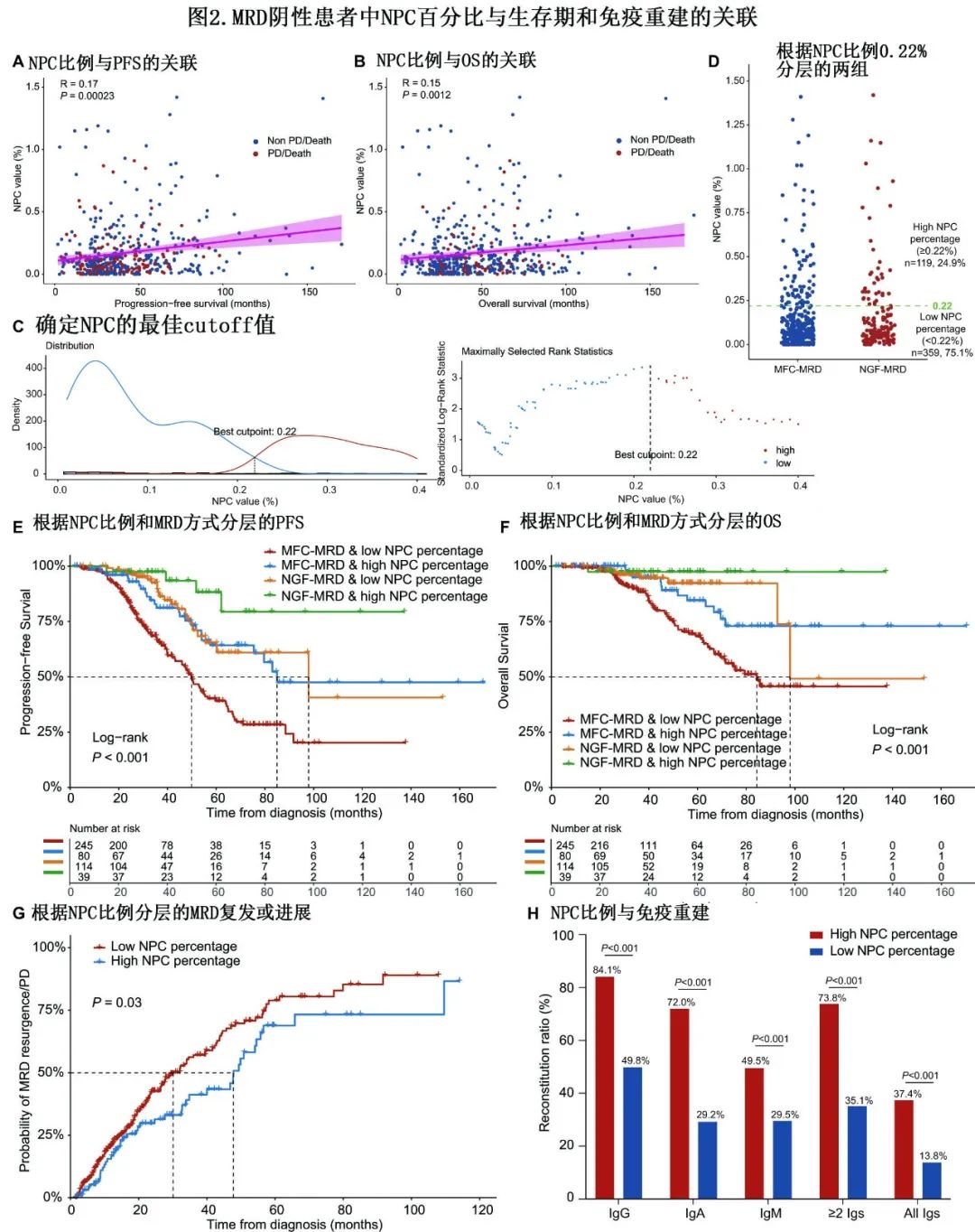
残存NPC比例可细化MRD阳性节点的风险分层
作者进一步估计了残存NPC在MFC/NGF-MRD阳性患者中的临床价值(n=441)。不同残存肿瘤log水平的中位NPC比例有显著差异(≥10-3 vs 10-4 vs 10-5为5.26% vs.67.29% vs. 91.84%,P<0.001;图3A)。此外NPC比例与-log10(肿瘤负荷)呈显著正相关(R=0.76,P<0.001;图3B),显示BM中残余NPC比例与肿瘤浆细胞(TPC)之间为竞争关系。考虑到肿瘤负荷与预后的相关性,作者参照传统的M蛋白缓解标准(SD、PR、VGPR、CR),将不同NPC比例分为低(NPC比例<50%,64.6%)、中(NPC比例50-90%,26.3%)和高(NPC比例≥90%,9.1%) 3组(图3C),mPFS分别为19.0个月、32.2个月和47.9个月 (P<0.001,图3D),mOS分别为51.0个月、69.8个月和未达到(P<0.001;图3E)。不同NPC组间有统计学差异。界标分析也显示类似结果。
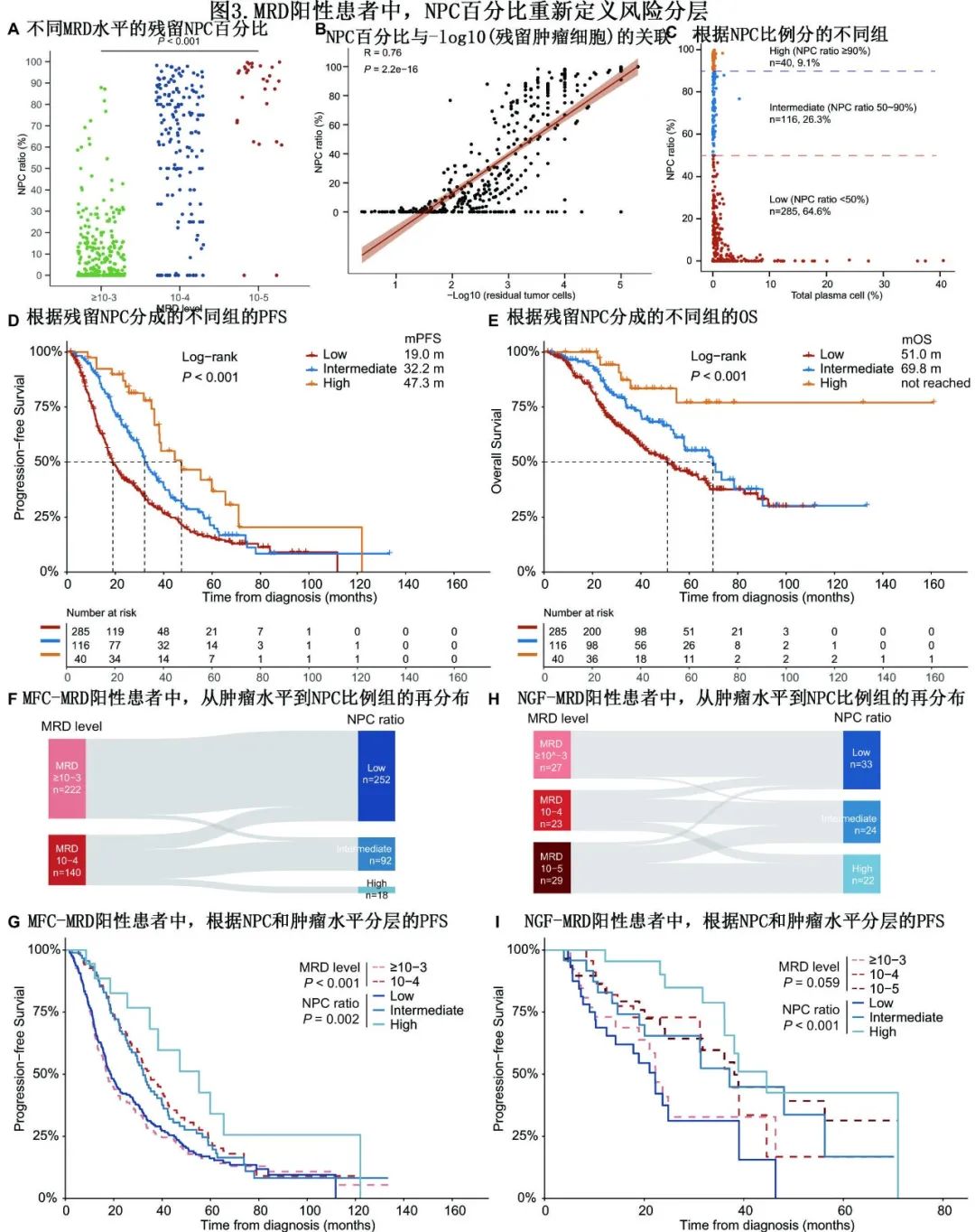
进一步分别对MFC-MRD和NGF-MRD亚组进行类似分析。在MFC-MRD阳性队列中,NPC比例分类进一步将两个不同的MRD水平组划分为三组(图3F),并在生存结局中显示出优越的判别功效(图3G)。在NGF-MRD阳性队列中,从MRD水平组到NPC比例分类观察到类似的再分布(图3H);重要的是,三个NPC比例组具有不同的预后(mPFS:高44.5个月vs中37.1个月vs低22.2个月,P<0.001),但不同肿瘤水平的患者生存结局相似(P=0.059;图3I)。此外,界标生存分析还显示,在NGF-MRD阳性队列中,NPC比例组比MRD水平组具有更大的判别优势。当用MRD对患者进行分层时,mOS分析显示出惊人的相似性。
基于NPC比例的时间依赖性动态MRD模型
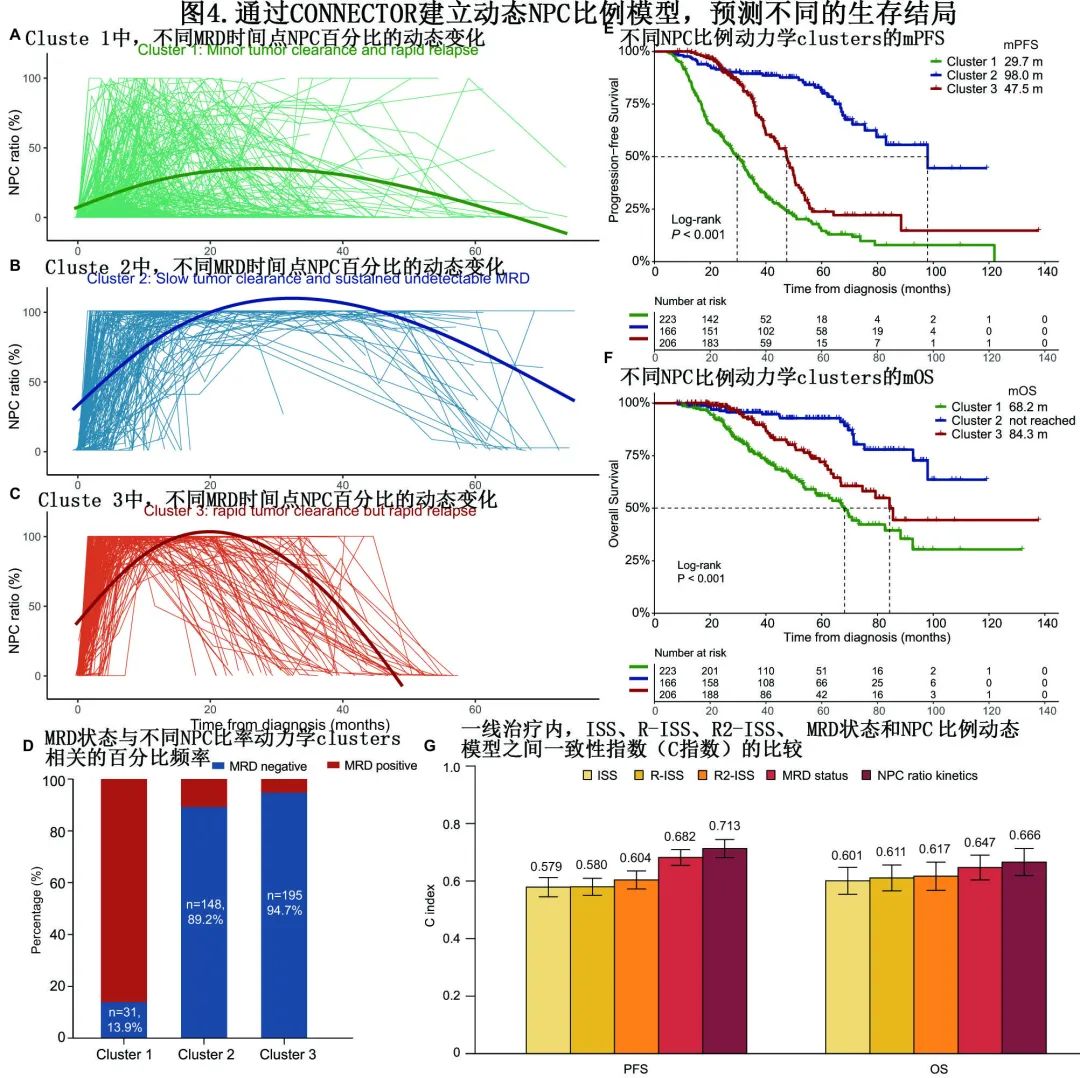
考虑到优异预测效果及克服不同MRD检测手段之间差异的潜力,作者探索了纵向MRD与预后之间的动态相关性,进一步选择至少有4个MRD样本的患者(n=595),并采用计算框架CONNECTOR将其分为三组:Cluster 1(n=223)、Cluster 2(n=166)和Cluster 3(n=206),三组的NPC比例动力学表现出显著差异(图4A-C)。在Cluster 1中,大多数患者表现出肿瘤清除小、复发快的模式,仅31例(13.9%)达到MRD阴性(图4D)。而在Cluster 2和Cluster 3中,大多数患者实现MRD阴性(图4D);但两组患者实现MRD阴性的中位时间存在显著差异(Cluster 2 vs.3:9.90个月vs. 4.77个月,P<0.001),Cluster 2表现为肿瘤清除缓慢且持续MRD阴性,Cluster 3表现为肿瘤清除迅速但复发迅速。除了年龄、贫血发生率和t(11;14)外,三个组表现出可比较的基线特征,但预后有显著差异,Cluster 1、2、3患者的mPFS分别为29.7、98.0、47.5个月(P<0.001;图4E),mOS为68.2个月、未达到、84.3个月(P<0.001;图4F)。多因素分析显示,即使在单一MRD状态、免疫麻痹或基线预测指标的情况下,动态NPC模型对mPFS和mOS也有独立的影响。与经典预测模型相比,在一线治疗中,PFS和OS的NPC比率动力学显示出比ISS、R-ISS、R2-ISS和MRD状态更高的一致性指数(c指数)。特别是,预测PFS的c指数差异具有统计学意义(图4G)。
总结
该研究通过包含1363例NDMM的大型回顾性分析,显示具有基线高 NPC比例 (≥5%) 的骨髓瘤患者表现出明显的惰性特征,其特征为较低的肿瘤负荷,以及血细胞减少、免疫麻痹和高危细胞遗传学的频率较低。重要的是,诊断或复发时高残存NPC比例与有利的生存期独立相关。MRD阴性伴NPC高比例与优越的临床获益和免疫重建相关。在 MRD节点,基于 NPC 比例 (<50%、50-90%、≥90%) 的分组显示风险分层优于残存肿瘤log水平。基于时间依赖性 NPC 比例趋势,作者进一步开发了一个动态 MRD 模型,将患者分为三组,具有不同的纵向趋势,并导致不同的预后。
该研究为骨髓瘤不同疾病阶段的免疫表型正常的NPC的临床意义提供了全面的证据。BMPC中残存NPC的持续存在预示着良好的预后,无论是在诊断时还是首次复发时。与肿瘤log水平相比,MRD阳性节点的NPC比例可以代表一种新的MRD状态分类方法,并实现更好的分类。作者还建立了一个时间依赖性动态NPC比例模型,可提供最佳的预后分层。最后,处于MRD阴性状态的高NPC比例与优越的生存结局和改善的免疫重建相关。总体而言,骨髓残存 NPC 不仅是危险分层的重要生物标志物,同样可在骨髓瘤MRD再分层和动态评估中发挥重要作用。
参考文献
Yan, W., Shi, L., Xu, J. et al. Clinical implications of residual normal plasma cells within bone marrow across various disease stages in multiple myeloma. Leukemia (2024). https://doi.org/10.1038/s41375-024-02366-9


