STTT:复旦大学卫功宏团队研究揭示表观遗传解读器ZMYND11非规范功能限制HNRNPA1介导的应激颗粒形成和致癌活性
时间:2024-10-09 16:00:24 热度:37.1℃ 作者:网络
表观遗传学读本经常影响基因调控,与疾病预后相关,并具有作为癌症治疗靶点的巨大潜力。锌指MYND-type containing 11 (ZMYND11)因读取表观遗传标记H3.3K36me3而被显著识别;然而,其在癌症中的更广泛的功能和作用机制仍未被充分探索。
2024年9月28日,复旦大学卫功宏团队在Signal Transduction and Targeted Therapy在线发表题为“Epigenetic reader ZMYND11 noncanonical function restricts HNRNPA1-mediated stress granule formation and oncogenic activity”的研究论文,该研究结果揭示了ZMYND11作为非组蛋白甲基化解读器的非规范作用,并强调了精氨酸甲基化在ZMYND11-HNRNPA1相互作用中抑制肿瘤进展的关键重要性,从而提出了新的治疗靶点和潜在的癌症治疗生物标志物。
研究阐述了ZMYND11下调在各种癌症中普遍存在,并且与前列腺癌患者较差的预后密切相关。ZMYND11的缺失在体外促进肿瘤细胞的生长、迁移和侵袭,在体内促进肿瘤的形成和转移。在机制上,研究发现ZMYND11通过识别依赖于MYND结构域的精氨酸-194甲基化的HNRNPA1,从而将HNRNPA1保留在细胞核中,并阻止细胞质中应激颗粒的形成,从而发挥肿瘤抑制作用。此外,ZMYND11抵消了HNRNPA1驱动的PKM2/PKM1比值的增加,从而减轻了PKM2促进的侵袭性肿瘤表型。值得注意的是,ZMYND11对HNRNPA1的识别可以通过药物抑制精氨酸甲基转移酶PRMT5而中断。ZMYND11低表达的肿瘤对PRMT5抑制剂敏感。

癌症是一种复杂的疾病,其特点是癌基因和肿瘤抑制因子之间错综复杂的相互作用,在肿瘤的发生、发展和治疗反应中起着关键作用。这些过程的核心是调节基因表达和维持细胞特性的表观遗传修饰。异常的表观遗传修饰导致表观基因组的失调,与癌症的发生和发展密切相关。这种失调是通过表观遗传“读取器”、“写入器”和“擦除器”之间复杂的相互作用精心策划的,它们共同调节染色质景观和基因表达。ZMYND11(也被称为BS69)是一个值得注意的表观遗传解读子,它通过其PHD-bromo-PWWP (PBP)结构域选择性识别组蛋白H3.3 (H3.3 k36me3)上赖氨酸36的三甲基化。ZMYND11的突变和功能障碍经常与包括癌症在内的各种疾病有关,H3.3 k36me3与基因体内富集的活性转录有关,H3.3组蛋白变异在活性染色质区域达到峰值。有趣的是,有证据表明,ZMYND11主要通过调节转录延伸期的RNA聚合酶II (Pol II)来抑制基因表达。此外,组蛋白读取结构域PBP位于ZMYND11的N端,而位于其C端的MYND结构域主要与下游癌基因的转录抑制以及与特定转录因子和剪接相关蛋白的相互作用有关。这些发现强调了ZMYND11在解释组蛋白修饰和通过各种合作蛋白调节转录方面的多方面作用。这种功能多样性提高了ZMYND11可能具有非规范功能的可能性,包括非常规活性和对关键癌蛋白的拮抗作用,这可能对抑制癌症进展至关重要。
细胞应激反应越来越被认为是癌症发生和发展的关键因素。这些反应的一个关键方面是mRNA翻译的重编程,这是一种使细胞在不利条件下适应和生存的机制。新出现的证据强调应激颗粒(SGs)在调节基因表达和蛋白质翻译中的作用,这是癌细胞存活和增殖所必需的过程。应激颗粒是一种动态的无膜细胞器,它们在真核细胞的细胞质中短暂聚集,以响应各种环境应激,如热休克、氧化应激和营养剥夺。它们的形成主要是由细胞应激过程中非翻译mRNA和相关蛋白的积累所驱动的。由于异常应激颗粒在毒性蛋白聚集和成核中的潜在作用,它们与几种神经退行性疾病的发病机制有关,包括额颞叶痴呆和肌萎缩侧索硬化症。在癌症的背景下,应激颗粒赋予恶性细胞生存优势,促进化疗耐药性,并在包括癌症在内的各种人类疾病中发挥关键作用。最近的研究表明,应激颗粒作为一种动态系统,能够整合致癌信号和肿瘤相关的应激刺激,从而增强癌细胞的适应性。尽管我们对应激颗粒及其在细胞应激反应中的作用的理解取得了重大进展,但精确的分子相互作用和控制其组装和拆卸的机制在很大程度上仍然难以捉摸。
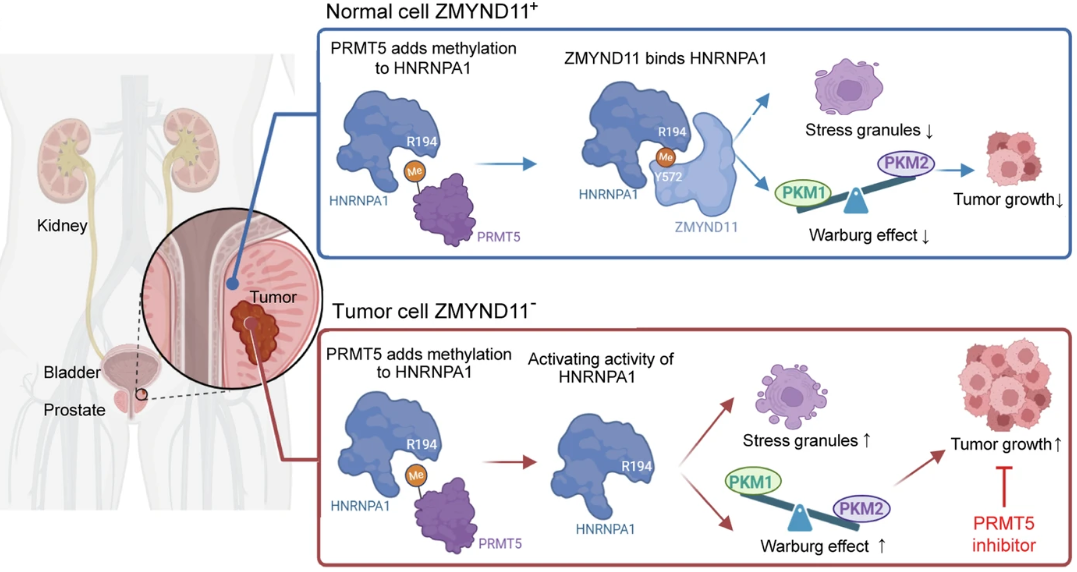
ZMYND11识别精氨酸甲基化限制HNRNPA1介导的肿瘤进展(图源自Signal Transduction and Targeted Therapy)
应激颗粒的形成是一个高度动态的过程,主要由某些RNA结合蛋白(RBPs)的精氨酸-甘氨酸-甘氨酸重复序列(RGG)结构域内的特定决定因素驱动。已知不对称和对称二甲基化RGG结构域均可诱导相分离,导致应力颗粒的形成。含有RGG结构域的蛋白,异质核核糖核蛋白A1 (HNRNPA1),因其在细胞应激条件下形成应激颗粒的能力而被特别注意。这些非膜结合的隔室在应激反应中暂时聚集,并与不良的疾病预后有关。HNRNPA1在基因表达中起基础作用,是一个关键的RBP。它包含两个RNA识别基序(RRM)和一个富含甘氨酸的结构域,其中包括几个Arg-Gly-Gly (RGG)三肽重复序列。这些结构元件使HNRNPA1介导细胞区隔化、蛋白-蛋白相互作用和RNA结合。尽管HNRNPA1在这些过程中具有重要作用,但控制其在癌症中的致癌功能的分子机制在很大程度上仍然难以捉摸。此外,目前还没有直接针对HNRNPA1的治疗策略。鉴于应激颗粒与化疗耐药的关联,靶向它们的组装可能提供一种有希望的治疗策略,以克服原发性和获得性耐药,从而提高治疗效果。然而,应激颗粒形成的确切机制尚不完全清楚,HNRNPA1在驱动癌症致癌过程中的作用需要进一步阐明。
RGG结构域中精氨酸残基的甲基化是由精氨酸甲基转移酶(PRMTs)家族催化的。目前,人们正在探索PRMT抑制剂作为一种有前景的癌症治疗策略,并提出了多种机制来解释PRMT抑制的效果。然而,目前尚不清楚精氨酸甲基化是否可以被某些蛋白质解读器特异性识别,以及这些相互作用是否具有治疗潜力。研究阐述了ZMYND11通过非规范功能在抑制肿瘤细胞增殖、代谢和癌症进展中发挥关键作用。该功能涉及其与PRMT5介导的HNRNPA1精氨酸甲基化的相互作用,从而抵消HNRNPA1的致癌潜力。此外,研究证明了ZMYND11低表达的肿瘤对II型精氨酸甲基转移酶PRMT5抑制剂的敏感性增强,这突出了针对ZMYND11失调的癌症的潜在治疗途径。
参考消息:
https://www.nature.com/articles/s41392-024-01961-7


