【BCJ】急性髓系白血病细胞遗传学和分子学异常及其对靶向治疗的影响
时间:2024-09-25 17:01:30 热度:37.1℃ 作者:网络
随着对急性髓系白血病(AML)分子病理学的不断认识,也促进了治疗靶点的确定和相应的新型靶向治疗的发展。自2017年以来,至少已有12种药物获批用于治疗AML。
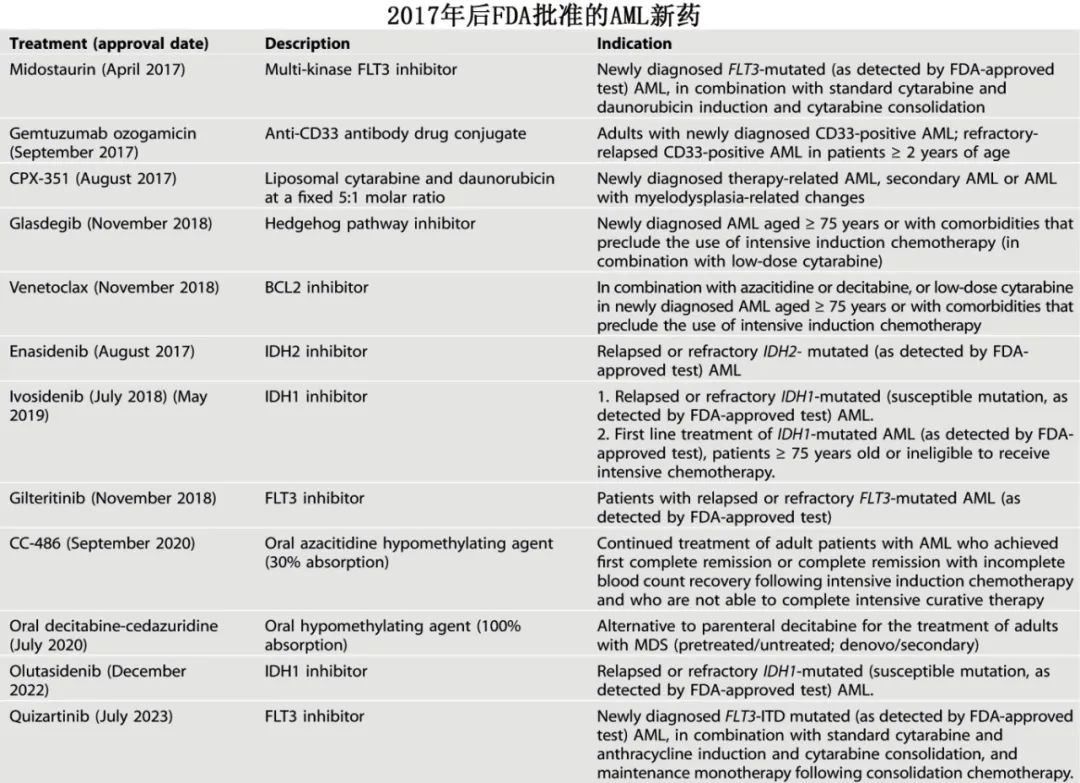
AML领域进展非常快,治疗选择也非常多,常规来说需要大型随机对照研究才能确定优劣,但该领域发展之快,导致很多数据报道出来就已经过时。
MD安德森癌症中心Hagop Kantarjian教授等近日于《Blood Cancer Journal》发文,概述了哪些患者和白血病相关特征适合靶向治疗,并阐述了在未来5年内可能成为标准治疗的新型方案,还介绍了MD安德森癌症中心的治疗经验。因为原文较长,分两部分分享,本文为上半部分(细胞遗传学和分子学异常及MRD的价值,约6千字),下半部分为治疗(约2万字),敬请期待。

细胞遗传学和分子学异常
虽然 AML的细胞遗传学-分子异常谱似乎很复杂,但实际上相对简单(下表)。
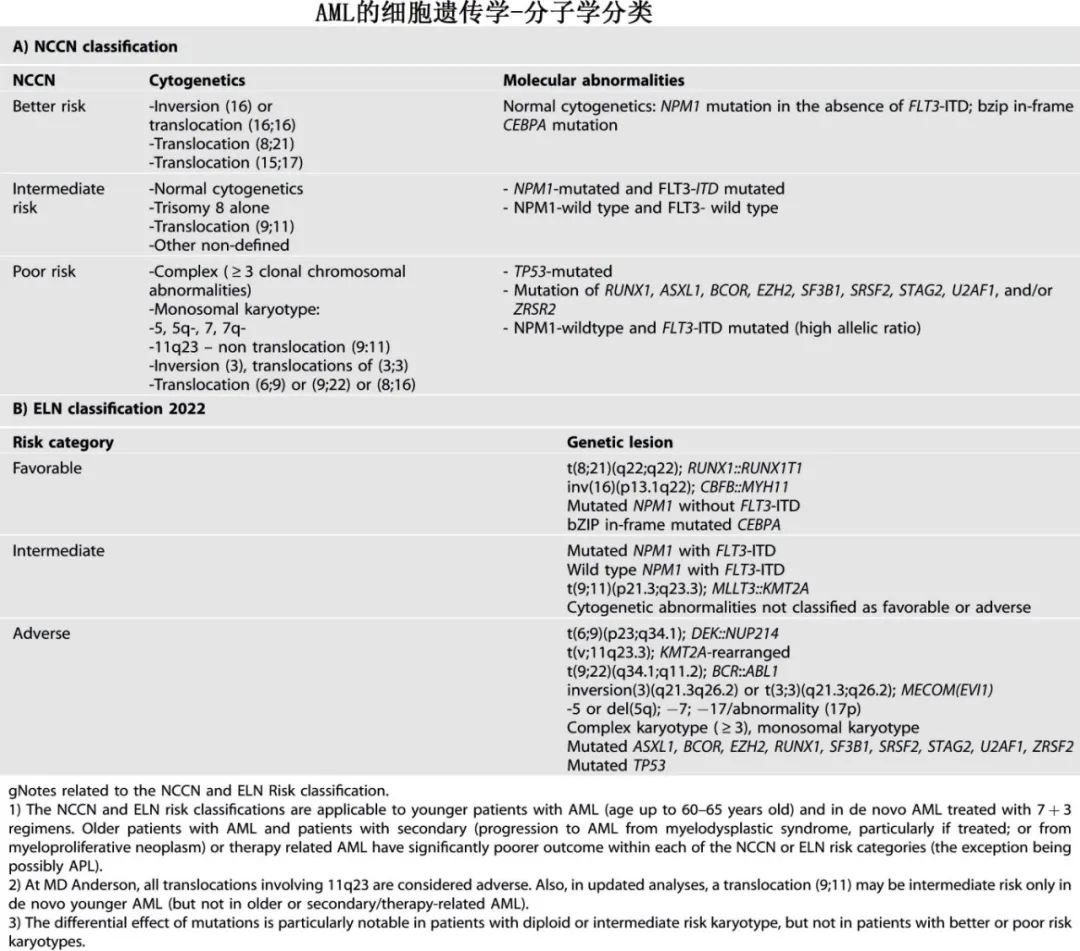
细胞遗传学可分为以下几类:(1)低危细胞遗传学,包括具有特征性易位15;17[t(15;17) (q22,q21)]的APL;具有16号染色体染色体倒位[inv16(p13;q22)]或易位16;16 [t(16;16)(p13;q22)]和易位8;21[t(8;21)(q22;q22)]的CBF AML;;(2)中危细胞遗传学,最常见的是二倍体核型(约40-50%的患者);(3)高危细胞遗传学伴复杂核型,特别是具有3+异常、染色体17p(编码 TP53基因的位点)丢失和/或易位/倒位3q26(MDS1/EVI1 complex locus on chromosome 3q26.2;;MECOM重排);(4)其他细胞遗传学/分子学异常。不同研究和分类中的高危类别也有差异(上表)。此外对于部分患者,例如费城染色体(Ph)阳性 AML和 KMT2A重排 AML,有前景的新型靶向药物(第三代BCR::ABL1酪氨酸激酶抑制剂;menin抑制剂)联合标准化疗亦可改善风险分类。在标准强化疗的基础上加用 FLT3抑制剂同样可改善 FLT3-ITD AML的预后,因此最新的ELN 2022将接受化化疗的年轻 AML患者(< 60岁)重新分配至中危组(不考虑 FLT3等位基因比率或 NPM1共突变)。标准治疗下,AML伴 TP53缺失(或由于染色体17p)突变或丢失或 MECOM重排的预后极差。
二代测序(NGS)可在90%的 AML患者中检测到复发性体细胞突变,其中频繁突变的基因(>5%)包括FLT3、NPM1、DNMT3A、IDH1、IDH2、TET2、RUNX1、TP53、 NRAS、CEBPA、WT1,但其中许多突变基因在年轻患者与老年患者中的频率不同(例如FLT3更常见于年轻 AML, TP53突变更常见于老年AML)。在AML的克隆优势和转移路径中,突变表现出共存或互斥的模式,可能有助于优化未来更合理的靶向治疗和有效的靶向治疗组合。AML的分子畸变可以是预后性(在标准强化化疗的情况下)、预测性(维奈克拉、FLT3、IDH1/2、BCR::ABL1和 menin抑制剂等治疗联合标准化疗时)和可靶向的(正如NPM1、FLT3、IDH1/2突变、BCR::ABL1融合和 KMT2A重排)。了解细胞遗传学/分子学结果的意义并据此采取行动正在迅速演变,但有时也会混淆,因此简单的解释有助于做出实际可行的治疗决策。
突变的预测意义在中危细胞遗传学(二倍体或“其他”)中最显著,存在高危细胞遗传学(复杂核型、染色体 17p丢失、MECOM重排)则通常取代突变;当代方案治疗下,低危核型(APL、CBF AML)中的突变可能并无不良影响(例如APL的FLT3突变;CBF AML中的C-KIT、FLT3或 NRAS突变)。
NPM1突变对正常核型年轻 AML患者预后良好,患者对大剂量阿糖胞苷、维奈克拉为基础的治疗方案、gemtuzumab ozogamicin和menin抑制剂为基础的联合治疗反应良好。2-20%的患者发生抑癌基因TP53(位于17号染色体短臂)的突变和/或缺失,且在高龄和继发性AML(既往血液疾病后)或治疗相关AML患者中更常见,并与复杂细胞遗传学 (90%) 和不良预后相关(除外10-15%的 TP53 突变 AML 病例,他们具有不常见的 TP53 单等位基因突变、VAF <20%和二倍体核型)。在采用大剂量阿糖胞苷方案治疗的新诊断AML中,NRAS突变可预测良好结局。但 RAS通路突变(包括NRAS、KRAS、PTPN11、NF1)通常经过克隆选择(通过突变获取或克隆扩增)作为 AML复发的耐药机制,尤其是在接受减低强度治疗的患者中(如接受 FLT3抑制剂方案的 FLT3突变 AML患者、接受 IDH抑制剂方案的 IDH突变 AML患者以及 HMA-维奈克拉治疗后)。令人惊讶的是,BCR::ABL1融合偶尔出现在靶向治疗治疗失败后的复发环境中(特别是在 FLT3抑制剂治疗后),表明应在靶向治疗后疾病复发状态检测该融合,因为这些患者可能对含有BCR::ABL1抑制剂的联合治疗有反应。
在具有二倍体核型的患者中,单一突变可能具有与组合不同的预测价值,例如,NPM1突变不伴FLT3突变的预后更佳。如果存在 FLT3-ITD突变(50%的二倍体核型携带 NPM1突变),历史上的预后明显更差,但现在 FLT3抑制剂治疗可改善预后。在含靶向治疗的现代方案背景下需要阐明的其他突变相互作用包括:NPM1和/或 FLT3-ITD突变同时存在以下一种或多种突变:DNMT3A、WT1、RUNX1、IDH1/2或其他。
突变的预测意义取决于具体情况(相关突变、AML亚群、突变克隆的大小和预期治疗),并随着更大规模分析的进行而不断发展。有一个很好的类比,那就是将突变视为不同角色和不同游戏中的演员。AML/患者(剧本)的特定结局取决于哪些突变共存(剧本或其他剧本中的不同演员)、其大小或变体等位基因频率(VAF)(演员的角色有多大)以及给予的治疗(剧本的编剧和导演/经理)。举例说明。ELN 2022分类适合接受7+3方案的年轻/fit AML,重要突变包括:NPM1无FLT3(低危)、bZIP框内突变CEBPA(低危);和ASXL1、BCOR、EZH2、RUNX1、SF3B1、SRSF2、STAG2、U2AF1、ZRSR2、TP53(均高危)。但该分类无法预测 HMA-维奈克拉治疗方案治疗的老年/unfit AML的结局,而是建议使用含NRAS、KRAS、FLT3-ITD、TP53的4基因方案,后者已在使用 HMA-维奈克拉时独立验证,但未在克拉屈滨-低剂量阿糖胞苷-维奈克拉交替HMA-维奈克拉中验证。在 MD安德森研究中,多因素分析已确定复杂细胞遗传学后的独立显著突变并考虑了患者和白血病相关特征。在年轻/fit AML患者中, NPM1突变为低危,而TP53和 PTPN11突变为高危;但如果在一线治疗中添加 FLT3抑制剂并在首次CR进行异基因 HSCT,则FLT3突变不再高危。在老年患者中(多接受减低强度治疗),NPM1和 IDH2突变为低危,TP53突变为高危。另一个例子是低危AML(ELN 2022),其中15%存在继发性突变(SRSF2、STAG2、ASXL1、EZH2、SF3B1、BCOR、U2AF1、ZRSR2),与更差的 CR率(82% vs 93%;P=0.002)和生存期(5年发生率48% vs 68%;P=0.0001)相关。
随着多个研究尘埃落定,以及实施包含维奈克拉和其他靶向治疗的更有效治疗方案,这些预测模型也将演变,临床实践中应考虑的、当前各分析中一致的不良因素包括:高龄(75–80+岁);体能差状态和器官功能障碍;复杂核型; TP53突变(也可能是 MECOM融合和 PTPN11突变)。重要和临床有意义的突变见下表。
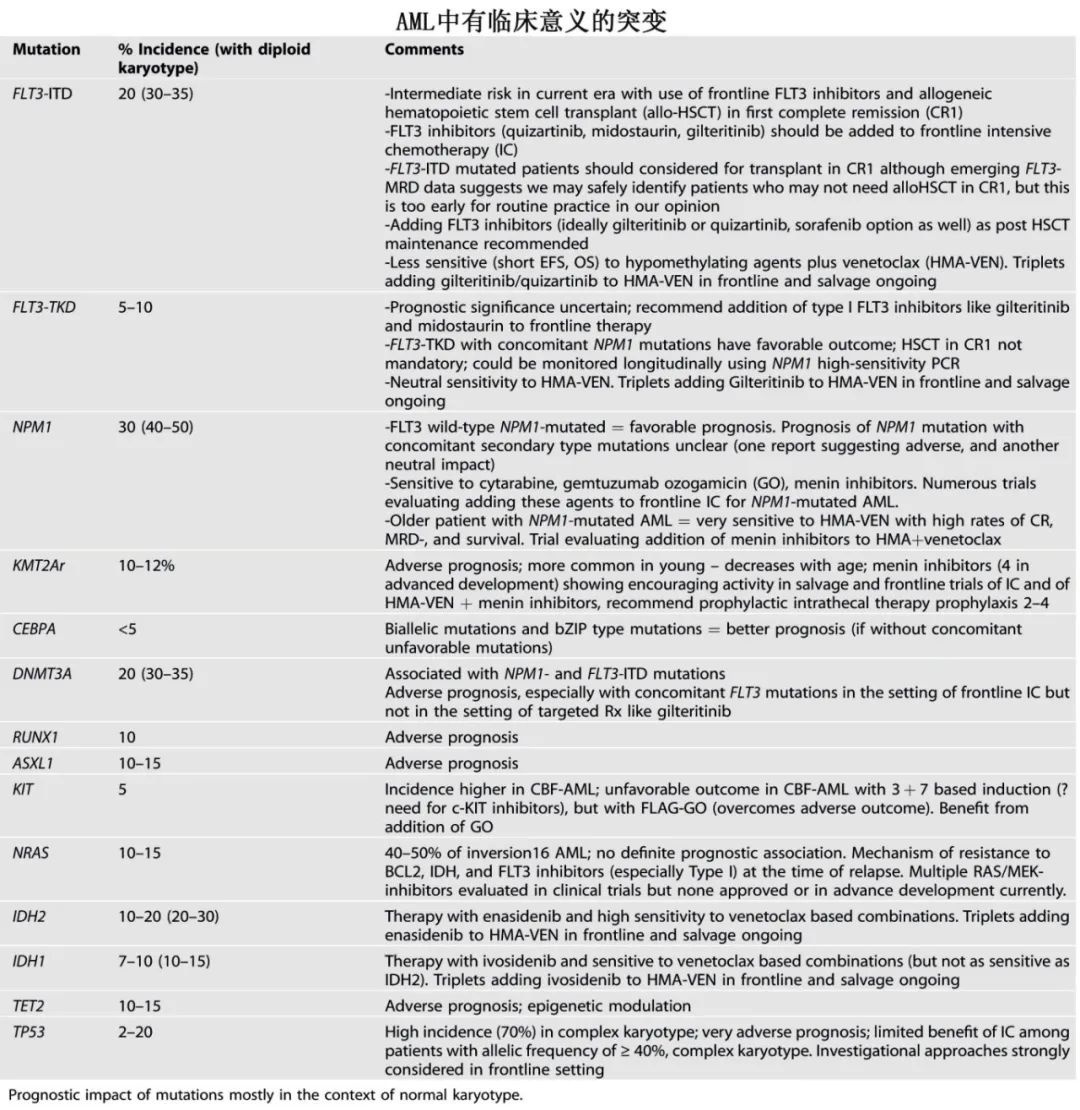
突变的意义受突变克隆大小的影响。在除 FLT3外的所有突变中,克隆大小均表示为“变异等位基因频率”(VAF;变异等位基因拷贝数/所有等位基因拷贝数的比值)。FLT3突变 AML在历史上曾被表示为 FLT3等位基因比率(AR),指 FLT3-ITD除以半定量 DNA片段分析得到的 FLT3-野生型曲线下面积。这很混乱,可能是时候改变 FLT3突变 AML克隆并量化为VAF,这在最近的研究中应用较为频繁。
急性髓性白血病患者中遗传易感性可能高达10%,突出了部分突变可能是胚系。例如 Li-Fraumeni综合征(胚系 TP53突变)和 DDX41突变等。胚系突变可以怀疑的情况:根据类型(例如约50%杂合频率的DDX41突变)或当患者和家庭中发生多种肿瘤时,或在某些基因型-表型相关时(例如终身血小板减少症和RUNX1、ANRKD26或ETV6突变;复发性感染或免疫缺陷和GATA2或SAMD9或SAMD9L突变)。当 VAF较高(>40–50%)时,应怀疑存在胚系变体,尤其是当形态学CR AML患者的高 VAF保持稳定时。胚系突变的存在可能具有治疗提示,应进行评价:在遗传性骨髓功能衰竭综合征(如范可尼贫血或端粒生物学疾病)情况下耐受强化疗的能力;如果适合异基因HSCT,最佳供者选择;治疗选择。例如在 DDX41 突变 AML 中,在化疗基础上加用维奈克拉可改善结局。
细胞遗传学-分子学知识的转化
将该分子学知识转化为临床实践,目前应侧重于如下情况:在 FLT3突变AML中中添加 FLT3抑制剂 (30%);使用大剂量阿糖胞苷、HMA-维奈克拉治疗 NPM1突变AML(正常核型患者中40-50%),或 menin抑制剂;IDH1/2突变 AML患者(20%)加用 IDH抑制剂;含menin抑制剂方案治疗KMT2A重排 AML(上表)。然而与费城样急性淋巴细胞白血病一样,FLT3样标记物(FLT3野生型AML中40-50%)也可能具有临床意义且可被 FLT3抑制剂靶向,正如menin抑制剂可能对具有 HOXA9/MEIS1标记物(30-40%)的 AML有效。
除 FLT3-ITD突变外,酪氨酸激酶结构域还可能发生 FLT3点突变(FLT3-TKD突变,AML中5-7%;预后优于 FLT3-ITD突变 AML;D835 最常见)。Midostaurin和吉瑞替尼(I型 FLT3抑制剂)对 FLT3-ITD和 FLT3-TKD突变均有效,而索拉非尼和quizartinib(II型 FLT3抑制剂)仅靶向FLT3-ITD。HMA与维奈克拉或 enasidenib联合治疗 IDH2突变 AML有效,但在一项随机研究中,仅HMA+维奈克拉方案证实生存优势。HMA联合艾伏尼布在 IDH1突变 AML中比维奈克拉更有效。在这些联合方案的基础上,HMA-维奈克拉联合FLT3抑制剂或 IDH1/2抑制剂的三联方案也为阳性结果。然而需要注意,虽然三药方案具有较高的 CR率和 MRD阴性率,但也具有骨髓抑制性,需要调整给药方案(例如基于诱导第14天的骨髓结果给予较短维奈克拉持续时间),并调整所有药物的给药方案和时间,尤其是 FLT3抑制剂。
对于 CBF AML,c-KIT突变与7+3方案的更差结局相关,但在氟达拉滨-阿糖胞苷-GO为基础的方案中无影响。研究在化疗中加入c-KIT抑制剂(avapritinib、达沙替尼)可能有用,包括索拉非尼联合化疗。FLT3突变常见于 APL(40%)和CBF AML,与诊断时白细胞增多相关,但 FLT3抑制剂在这两个亚群中未显示获益。
KMT2A重排 AML在历史上预后较差,活动性疾病和诱导治疗期间具有高发生率的弥散性血管内凝血病(DIC)和出血,以及高发生率的中枢神经系统(CNS)和髓外受累。如上所述,在一线治疗和挽救治疗中使用包含 menin抑制剂的联合治疗可显著改善预后。目前正在研究的 menin抑制剂包括revumenib、ziftomenib、bleximenib、enzomenib。
完全形态学缓解中的可测量残留病
形态学 CR的 AML患者中可检测到MR与高复发率和低生存率相关。测量 MRD的方法包括:(1)多色流式细胞术(MFC-MRD;灵敏度10-4);(2)逆转录酶定量聚合酶链反应(RTq-PCR)检测(优化后,灵敏度10-5);(3)标准二代测序(NGS) panel,灵敏度可变(通常仅1%);(4)超灵敏错误校正和突变特异性 PCR-NGS。PCR常规用于定量监测APL、CBF AML以及 NPM1突变和 FLT3突变中的 AML易位和突变。在 APL中,PCR定量早幼粒细胞白血病-维甲酸受体α(PML-RARa)可检测早期分子学复发。细胞遗传学异常倒位 16和t(16;16)可导致形成CBFβ/肌球蛋白重链 11(CBFB/MYH11)融合基因。t(8;21)涉及 runt相关转录因子 1(RUNX1)的融合和RUNX1易位到 1(RUNX1T1),从而产生 RUNX1/RUNX1T1融合基因。通过分子形式的定量 PCR检测 MRD CBF AML中的融合基因(尤其是倒位16)可预测复发。
在 AML的其他亚群中,CR中 MFC-MRD阳性状态与高复发率相关(80%)。然而MFC-MRD阴性状态并不十分可行,因其仍与30-40%的复发率相关,即使其常作为首次 CR时避免异基因HSCT的依据。通过高灵敏度 RTq-PCR或错误校正监测突变 MRD突变特异性 PCR-NGS(在 NPM1突变和 FLT3突变 AML中)可提供更多信息和更具有预测性。NPM1突变 AML中采用RTq-PCR(10-4)进行分子学监测或检测NPM1 MRD可高度预测复发风险和长期生存。同样,对于首次CR期接受HSCT的患者,使用靶向错误编码NGS(10−4)检测到移植前持续存在NPM1或FLT3-ITD突变也与复发增加和生存降低相关。在2个疗程强化诱导化疗后通过 RT-qPCR(10-5)达到 NPM1 MRD清除的患者可能未获益于 CR1期 HSCT(3年OS:79% vs 82%);即使分析仅限于 NPM1突变伴FLT3-ITD患者,结果仍是如此。FLT3-ITD AML且围移植期MRD阴性(纠正错误超灵敏PCR-NGS[10−6])患者可能无法从移植后FLT3抑制剂(如吉瑞替尼)维持治疗中获益。NPM1突变中类似的超灵敏新型 PCR-NGS检测也已现在可用。重要的是,诊断时用于识别和监测治疗中突变的常规非超灵敏NGS分子panel的灵敏度较低(1-2%),在决定是否进行异基因HSCT或维持治疗时不应依赖该分子组合进行 MRD评估(其在区分残留克隆性造血与残留 AML MRD方面也存在困难),尽管研究表明CR时这些panal检测到突变持续存在与高复发风险相关。结合 MFC和新型 MRD分子检测(RT-qPCR或超灵敏PCR-NGS)可进一步提高预测复发的能力。CR中持续存在 DTA突变(DNMT3A、TET2、ASXL1;通常与克隆性造血相关)的意义一直存在争议,有学者认为持续存在并不能预测复发,另其他人则认为可以。
伴随 CR期检测到 MRD,还需要考虑治疗干预的选择。在 APL中,与血液学复发时的干预相比,分子学复发时治疗可改善结局。在 CBF AML中,持续 MRD给予异基因HSCT可改善生存。MRD阳性 AML的重要干预措施可能包括以下:异基因HSCT;强化疗或 HMA/低剂量阿糖胞苷(联合维奈克拉和/或相应靶向治疗 [FLT3或 IDH抑制剂])方案;抗体治疗(例如CD123或 CD33抗体药物偶联物 [ADC]);免疫治疗(例如NK细胞治疗)。
参考文献
Kantarjian H, et al.Current status and research directions in acute myeloid leukemia.Blood Cancer J . 2024 Sep 19;14(1):163. doi: 10.1038/s41408-024-01143-2.


