礼来(Lilly)的Olumiant在狼疮、特应性皮炎适应症中遭遇挫折
时间:2022-02-03 14:18:19 热度:37.1℃ 作者:网络
系统性红斑狼疮 (SLE) 是一种慢性自身免疫性疾病,身体各器官均可受累,尤其是皮肤、关节、血液、肾脏及中枢神经系统(图1)。该疾病在非洲裔美国人,西班牙人,亚洲人和美国原住民中较为常见。
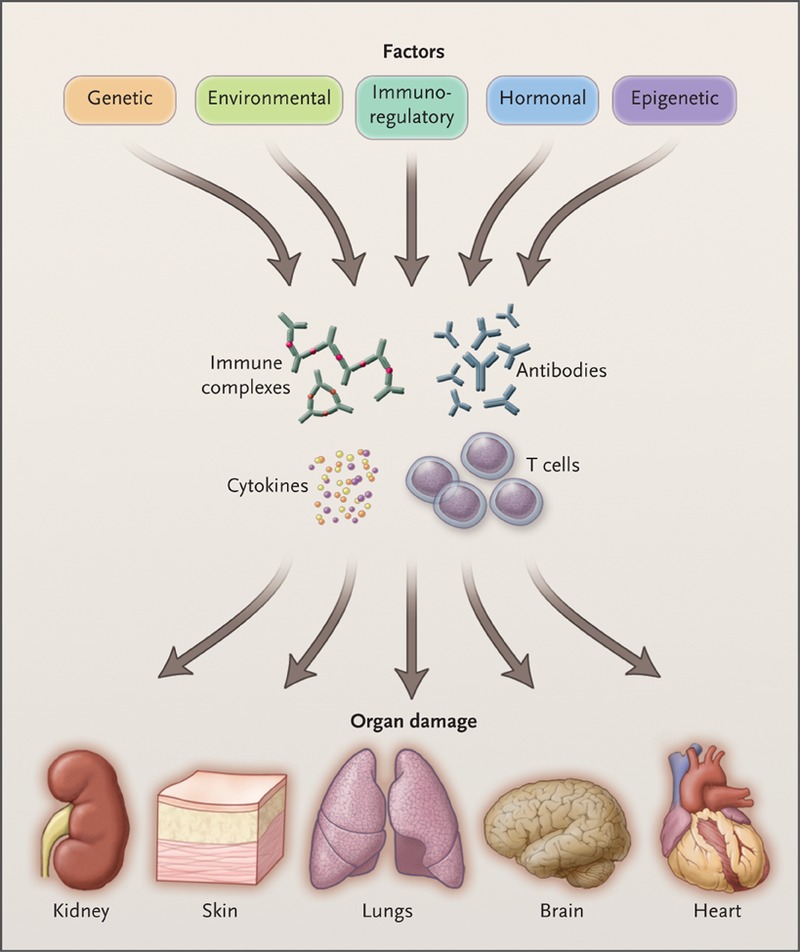
图1. 系统性红斑狼疮的致病因素和受累器官
礼来(Eli Lilly)和Incyte近日公布了两个挫折,影响了他们扩大 Olumiant(巴瑞替尼)适应症的计划。首先是他们决定在两项 III 期研究的混合结果之后结束该药物在系统性红斑狼疮 (SLE) 中的开发计划。两家公司还表示,尽管他们仍在与 FDA 进行持续谈判,但提交给 FDA 的 JAK1/JAK2 抑制剂用于特应性皮炎的申请可能会被拒绝。
两项 III 期 SLE-BRAVE-I 和 SLE-BRAVE-II 试验分别招募了 809 名和 777 名患有活动性 SLE 的成年患者。在每项研究中,患者被随机分配接受低剂量或高剂量的 Olumiant 或安慰剂,主要终点根据参与者达到 SLE 反应者指数 4 (SRI-4) 的百分比来衡量疾病活动。
SLE-BRAVE-I研究的结果显示,与安慰剂相比,4mg 口服剂量的 Olumiant 在第 52 周达到了主要终点,但 SLE-BRAVE-II 研究则没有达到主要终点。两项研究均未达到关键的次要目标。
关于特应性皮炎申请,礼来(Lilly)已在 8 项特应性皮炎试验中对 Olumiant 进行了评估,例如 BREEZE-AD1 和 2、BREEZE-AD4 和 BREEZE-AD7。
FDA 对该文件的审查于去年被推迟,以便该机构有时间评估其要求查看的其他分析。美国监管机构也正在对辉瑞的 JAK 抑制剂 Xeljanz(托法替尼)进行安全性审查,这最终导致 FDA 对包括 Olumiant 在内的同类药物发出更强烈的警告和限制。
原始出处:
https://firstwordpharma.com/story/5489131


