FDA批准Keytruda用于一线治疗宫颈癌
时间:2021-10-16 06:02:23 热度:37.1℃ 作者:网络
MSD的PD-1抑制剂 Keytruda (pembrolizumab) 已获得美国食品和药品监督管理局 (FDA) 的批准,用于某些宫颈癌患者的一线治疗。宫颈癌为发生在子宫颈的癌症,源自于不正常细胞的生长,能侵袭或转移至身体其他部位。早期通常不会有症状,而晚期时可能有不正常的阴道出血、骨盆腔疼痛。
FDA已经批准Keytruda联合化疗(有或没有贝伐单抗)用于PD-L1阳性的持续性、复发性或转移性宫颈癌患者。
在针对该患者群体的III期KEYNOTE-826试验中,与化疗相比,Keytruda联合化疗(有或没有贝伐单抗)在PD-L1阳性患者中表现出优于化疗的总生存期(OS)优势和无进展生存期(PFS)优势。
最重要的是,与单独化疗相比,更多的患者对Keytruda联合化疗有反应,总体反应率 (ORR) 分别为68%和50%。在有反应的患者中,Keytruda联合化疗组患者的中位反应持续时间 (DoR) 为18.0个月,而化疗组患者的这一数据仅为10.4个月。
更为重要的是,在化疗(紫杉醇加顺铂或卡铂)中加入Keytruda,联合或不联合贝伐单抗可使死亡风险降低33%,疾病进展和死亡风险降低35%,且与PD-L1状态无关,在Keytruda联合化疗组患者中均观察无进展生存期和总生存期获益(图1)。

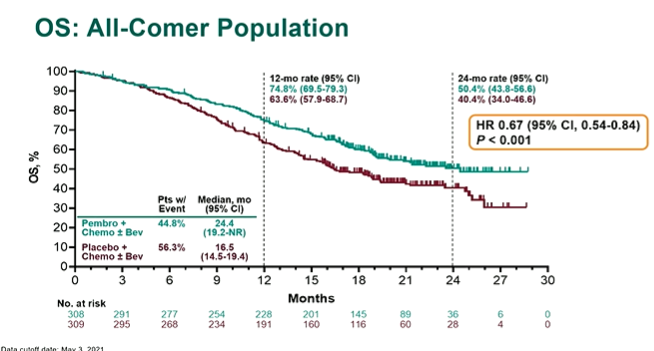
图1.Keytruda联合化疗显著提高PFS率和OS率
默克研究实验室全球临床开发负责人、首席医疗官Roy Baynes说:“今天的消息是向前迈出的有意义的一步,因为它为这些患者提供了一种新的治疗选择,并加强了Keytruda在治疗某些类型宫颈癌方面的作用”。
根据确证的KEYNOTE-826数据,FDA还将Keytruda作为单一药物用于治疗疾病进展的复发性或转移性宫颈癌患者(其肿瘤表达PD-L1)的加速批准转换为常规批准。
原始出处:
http://www.pharmatimes.com/news/fda_clears_keytruda_for_first-line_cervical_cancer_1380837


