再鼎医药重症肌无力新药皮下注射剂型艾加莫德α注射液国内申报上市
时间:2023-07-08 09:06:58 热度:37.1℃ 作者:网络
7月8日,CDE官网显示,再鼎医药艾加莫德α注射液(皮下注射,efgartigimod PH20 SC)上市申请获受理,推测适应症为全身型重症肌无力。
Efgartigimod是Argenx开发的一款FcRn单抗,可通过与FcRn结合起到减少致病性IgG抗体并阻断IgG循环的作用。2021年1月,再鼎医药与argenx达成独家授权合作,负责efgartigimod在大中华区的开发和商业化工作,交易总额为1.75亿美元。
2021年12月,静脉注射efgartigimod在美国获批上市,用于治疗抗乙酰胆碱受体(AChR)抗体阳性的全身型重症肌无力患者,商品名为Vyvgart。随后又在日本获批用于治疗对类固醇或非类固醇免疫抑制疗法(ISTs)没有充分应答的全身型重症肌无力成人患者。今年6月底,该产品在中国获批上市,成为国内首个且目前唯一获药监局批准的FcRn拮抗剂。
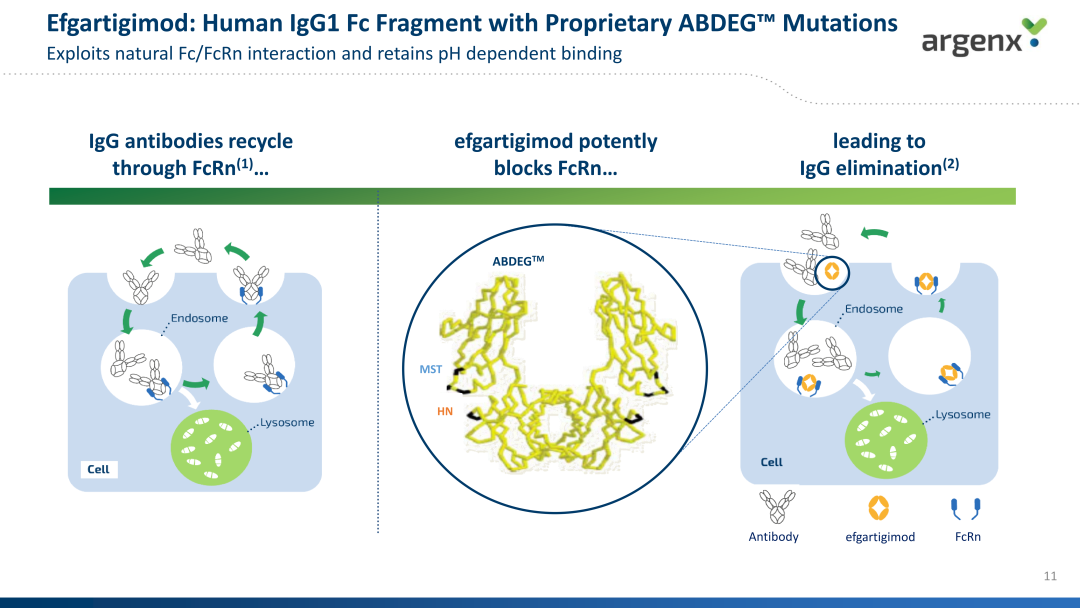
efgartigimod的作用机制
Efgartigimod PH20 SC是Vyvgart的改良制剂,由Argenx利用Halozyme公司的ENHANZE技术开发而来,该技术基于重组人透明质酸酶PH20 (rHuPH20) ,可促进通常通过静脉(IV)输注给药的生物制剂以皮下注射(SC)的方式递送药物。今年6月下旬,该改良制剂在美国上市,商品名为Vyvgart Hytrulo。
新剂型的上市申请主要基于III期ADAPT-SC研究的积极数据,旨在评估efgartigimod皮下注射与静脉输注在gMG成人患者中的药效学非劣效性。结果显示,第29天时,接受皮下注射治疗的患者IgG的降低(减少66.4%)在统计学上非劣效于静脉输注组(62.2%,p<0.0001),达到了主要终点。
此外,efgartigimod皮下注射治疗组,有69.1%患者达到了重症肌无力日常生活活动(MG-ADL)评分应答,并且有65.5%患者达到了定量重症肌无力(QMG)评分应答,1个治疗周期后,有37%患者实现了最少症状表达(MSE)这一衡量无症状状态的指标;另外,皮下注射的起效也与III期ADAPT研究一致。安全性方面,与既往研究一致,且患者总体耐受性良好。


