免疫检查点抑制剂相关结肠炎/腹泻的治疗和结局
时间:2023-07-02 11:03:22 热度:37.1℃ 作者:网络
引言
“消化前沿”专栏是北部战区总医院消化内科祁兴顺医生应《消化界》编辑部邀请联合发起的学术专栏,定期收集整理消化病领域的研究进展,每月(最后一周)挑选一篇重要文献进行精读讨论,希望能帮助读者知其然知其所以然,启迪临床科研思维、学以致用。今天为您带来第2期内容:免疫检查点抑制剂相关结肠炎/腹泻的治疗和结局。
文章简述
免疫检查点抑制剂(ICIs)的出现改变了包括黑色素瘤、非小细胞肺癌、肾细胞癌等在内的多种恶性肿瘤的治疗方式。ICIs主要包括程序性细胞毒性T淋巴细胞相关蛋白-4(CTLA-4)抑制剂(如易普利姆玛单抗和曲美木单抗)、程序性细胞死亡受体-1(PD-1)抑制剂(如帕博利珠单抗、纳武单抗和西米普利单抗)以及程序性细胞死亡配体-1(PD-L1)抑制剂(如阿替利珠单抗、度伐利尤单抗和阿维单抗)(Bagchi, et al. Annu Rev Pathol. 2021;16:223-49)。尽管ICIs的使用提高了癌症患者的总体生存率,但其常可造成涉及内分泌系统、皮肤、胃肠道和肝脏的免疫相关不良事件(irAEs)(Wolchok, et al. N Engl J Med. 2017;377(14):1345-56)。其中,胃肠道毒性是与ICIs相关的最常见、最严重的irAEs之一,也是导致ICIs停药的重要原因。最常见的胃肠道毒性表现为ICIs相关结肠炎/腹泻,其严重程度可根据大便频率和其他指标进行分级。低级别(1-2级)结肠炎/腹泻通常无症状或症状较轻,而高级别(3-5级)结肠炎/腹泻可引起严重的腹痛及排便习惯和粪便性状的改变,甚至死亡。结肠炎/腹泻分级与治疗方法的选择和结局密切相关。症状较轻的患者常采用对症治疗,如洛哌丁胺;中重度结肠炎/腹泻患者常使用皮质类固醇;而发生类固醇难治性结肠炎/腹泻的患者使用生物制剂可明显缓解症状。此外,严重的ICIs相关结肠炎/腹泻常导致ICIs的永久停药。
对于临床医生来说,全面了解接受ICIs治疗患者的结肠炎/腹泻的流行病学情况以及治疗选择、对各种治疗的应答和结局是很重要的。因此,我们进行了本项系统评价和荟萃分析来阐述ICIs相关结肠炎/腹泻的治疗和结局。
我们团队的Ding等于2023年3月在《Digestive and Liver Disease》杂志在线发表了一篇题为《免疫检查点抑制剂相关结肠炎/腹泻的治疗和结局:一项系统评价和荟萃分析》的文章。该研究旨在评估ICIs相关结肠炎/腹泻的治疗和结局。
我们系统检索了PubMed、EMBASE和Cochrane Library数据库中有关接受ICIs治疗的患者发生结肠炎/腹泻的治疗情况和结局的文章,末次检索日期为2022年10月25日。在初步确定的11492篇文章中,最终纳入27项研究。结果表明,任何级别结肠炎/腹泻、低级别结肠炎、高级别结肠炎、低级别腹泻和高级别腹泻的合并发病率分别为17%、3%、17%、13%和15%。合并总体应答率、合并皮质类固醇应答率和合并生物制剂应答率分别为88%、50%和96%。ICIs相关结肠炎/腹泻患者的合并死亡率为2%。ICIs永久停药和重新启用的合并发生率分别为43%和33%。
综上,ICIs相关结肠炎/腹泻很常见,但很少致命。一半的人对皮质类固醇治疗有应答,而类固醇难治性结肠炎/腹泻的患者对生物制剂的应答率相当高。
重要研究成果分析及其临床意义
1.纳入研究的特征
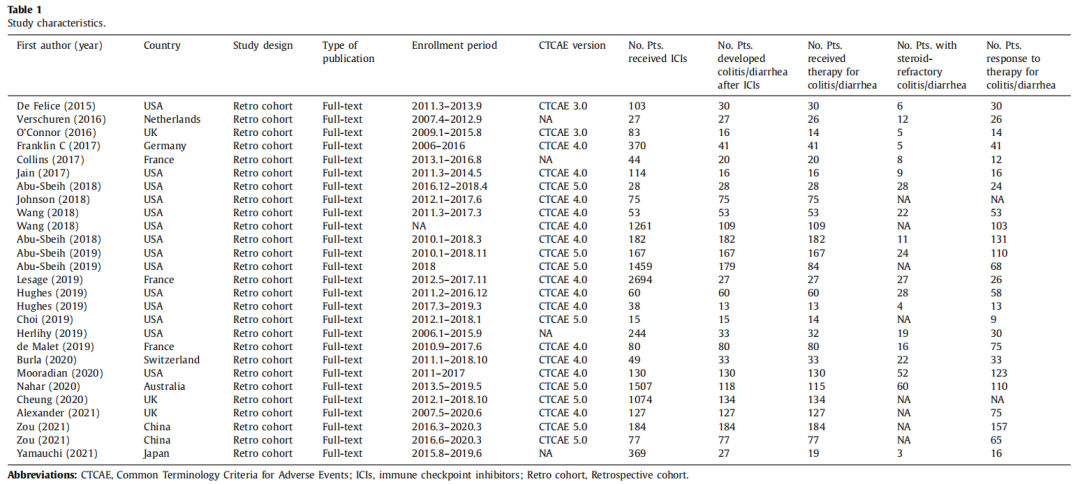
(表源自文献)
在纳入的27项研究中,来自美洲的研究有14项、欧洲9项、亚洲3项、澳洲1项;回顾性队列研究27项;基于不良事件通用术语标准(CTCAE)3.0版本进行的研究有2项、CTCAE 4.0版本13项、CTCAE 5.0版本8项、CTCAE版本不明确4项;高质量研究20项、低质量研究7项。
2.ICIs相关结肠炎/腹泻的发病率
2.1 任何级别结肠炎/腹泻
14项研究报道了接受ICIs治疗的患者中任何级别结肠炎/腹泻的发病率。结果显示,合并的任何级别结肠炎/腹泻发病率为17% [95%置信区间(confidence interval,CI):11%-23%],各研究间存在显著异质性(I² = 97.91%,P < 0.01)。亚组分析显示,低质量研究和高质量研究中,合并的任何级别结肠炎/腹泻发病率分别为67%和14%(Pinteraction < 0.01);黑色素瘤和混合类型肿瘤患者中,合并的任何级别结肠炎/腹泻发病率分别为16%和17%(Pinteraction = 0.80);应用CTLA-4抑制剂单药治疗、PD-1/PD-L1抑制剂单药治疗及PD-1/PD-L1抑制剂与CTLA-4抑制剂联合治疗的患者中,合并的任何级别结肠炎/腹泻发病率分别为8%、6%和4%(Pinteraction = 0.37);首次输注ICIs与发生结肠炎/腹泻症状的中位时间间隔<49天和≥49天的研究中,合并的任何级别结肠炎/腹泻发病率分别为8%和18%(Pinteraction = 0.16);接受内镜评估的患者数量<30和≥30的研究中,合并的任何级别结肠炎/腹泻发病率分别为23%和11%(Pinteraction = 0.09);中位随访时间<14个月和≥14个月的研究中,合并的任何级别结肠炎/腹泻发病率分别为12%和8%(Pinteraction = 0.33)。Meta回归分析结果显示,异质性可能来源于样本量和研究质量。研究间存在显著的发表偏倚(P = 0.001)。
2.2 低级别结肠炎
5项研究报道了接受ICIs治疗的患者中低级别结肠炎的发病率。结果显示,合并的低级别结肠炎发病率为3%(95% CI:2%-5%),各研究间存在显著异质性(I² = 71.04%,P = 0.01)。亚组分析显示,低质量研究和高质量研究中,合并的低级别结肠炎发病率分别为0%和3%(Pinteraction = 0.11);黑色素瘤和混合类型肿瘤患者中,合并的低级别结肠炎发病率分别为3%和14%(Pinteraction < 0.01);首次输注ICIs与发生结肠炎/腹泻症状的中位时间间隔<49天和≥49天的研究中,合并的低级别结肠炎发病率分别为3%和14%(Pinteraction = 0.01);接受内镜评估的患者数量<30和≥30的研究中,合并的低级别结肠炎发病率分别为4%和3%(Pinteraction = 0.50);中位随访时间<14个月和≥14个月的研究中,合并的低级别结肠炎发病率分别为2%和3%(Pinteraction = 0.20)。Meta回归分析未发现异质性的来源。研究间未发现显著的发表偏倚(P = 0.452)。
2.3 高级别结肠炎
5项研究报道了接受ICIs治疗的患者中高级别结肠炎的发病率。结果显示,合并的高级别结肠炎发病率为17%(95% CI:9%-26%),各研究间存在显著异质性(I² = 96.98%,P < 0.01)。亚组分析显示,低质量研究和高质量研究中,合并的高级别结肠炎发病率分别为67%和8%(Pinteraction < 0.01);黑色素瘤和混合类型肿瘤患者中,合并的高级别结肠炎发病率分别为14%和32%(Pinteraction = 0.02);首次输注ICIs与发生结肠炎/腹泻症状的中位时间间隔<49天和≥49天的研究中,合并的高级别结肠炎发病率分别为4%和32%(Pinteraction < 0.01);接受内镜评估的患者数量<30和≥30的研究中,合并的高级别结肠炎发病率分别为51%和4%(Pinteraction < 0.01);中位随访时间<14个月和≥14个月的研究中,合并的高级别结肠炎发病率分别为6%和4%(Pinteraction < 0.01)。Meta回归分析结果显示,异质性可能来源于样本量和研究质量。研究间存在显著的发表偏倚(P = 0.061)。
2.4 低级别腹泻
4项研究报道了接受ICIs治疗的患者中低级别腹泻的发病率。结果显示,合并的低级别腹泻发病率为13%(95% CI:7%-22%),各研究间存在显著异质性(I² = 76.84%,P < 0.01)。亚组分析显示,低质量研究和高质量研究中,合并的低级别腹泻发病率分别为31%和10%(Pinteraction < 0.01)。Meta回归分析未发现异质性的来源。研究间存在显著的发表偏倚(P = 0.037)。
2.5 高级别腹泻
4项研究报道了接受ICIs治疗的患者中高级别腹泻的发病率。结果显示,合并的高级别腹泻发病率为15%(95% CI:6%-28%),各研究间存在显著异质性(I² = 88.25%,P < 0.01)。亚组分析显示,低质量研究和高质量研究中,合并的高级别腹泻发病率分别为37%和11%(Pinteraction < 0.01)。Meta回归分析结果显示,异质性可能来源于CTCAE版本。研究间未发现显著的发表偏倚(P = 0.187)。
3.应答
3.1 总体应答
25项研究报道了1792例ICIs相关结肠炎/腹泻患者对任何治疗的总体应答率。结果显示,合并的总体应答率为88%(95% CI:81%-94%),各研究间存在显著异质性(I² = 94.30%,P < 0.01)。亚组分析显示,低质量研究和高质量研究中,合并的总体应答率分别为86%和89%(Pinteraction = 0.73);黑色素瘤和混合类型肿瘤患者中,合并的总体应答率分别为97%和79%(Pinteraction < 0.01);首次输注ICIs与发生结肠炎/腹泻症状的中位时间间隔<49天和≥49天的研究中,合并的总体应答率分别为92%和88%(Pinteraction = 0.55);接受内镜评估的患者数量<30和≥30的研究中,合并的总体应答率分别为91%和88%(Pinteraction = 0.87);中位随访时间<14个月和≥14个月的研究中,合并的总体应答率分别为85%和92%(Pinteraction = 0.47);接受皮质类固醇治疗和皮质类固醇联合生物制剂治疗的患者中,合并的总体应答率分别为84%和89%(Pinteraction = 0.59)。Meta回归分析结果显示,异质性可能来源于CTCAE版本和原发肿瘤的类型。研究间存在显著的发表偏倚(P = 0.077)。
3.2 对皮质类固醇治疗的应答
19项研究报道了982例ICIs相关结肠炎/腹泻患者对皮质类固醇治疗的应答率。结果显示,合并的皮质类固醇应答率为50%(95% CI:35%-65%),各研究间存在显著异质性(I² = 95.11%,P < 0.01)。亚组分析显示,低质量研究和高质量研究中,合并的皮质类固醇应答率分别为57%和49%(Pinteraction = 0.68);黑色素瘤和混合类型肿瘤患者中,合并的皮质类固醇应答率分别为52%和49%(Pinteraction = 0.87);首次输注ICIs与发生结肠炎/腹泻症状的中位时间间隔<49天和≥49天的研究中,合并的皮质类固醇应答率分别为59%和24%(Pinteraction = 0.03);接受内镜评估的患者数量<30和≥30的研究中,合并的皮质类固醇应答率分别为47%和48%(Pinteraction = 0.97);中位随访时间<14个月和≥14个月的研究中,合并的皮质类固醇应答率分别为48%和54%(Pinteraction = 0.79)。Meta回归分析结果显示,异质性可能来源于首次输注ICIs与发生结肠炎/腹泻症状的中位时间间隔。研究间未发现显著的发表偏倚(P = 0.392)。
3.3 类固醇难治性结肠炎/腹泻
19项研究报道了1101例ICIs相关结肠炎/腹泻患者中类固醇难治性结肠炎/腹泻的比率。结果显示,合并的类固醇难治性结肠炎/腹泻比率为42%(95% CI:28%-56%),各研究间存在显著异质性(I² = 95.17%,P < 0.01)。亚组分析显示,低质量研究和高质量研究中,合并的类固醇难治性结肠炎/腹泻比率分别为34%和44%(Pinteraction = 0.48);黑色素瘤和混合类型肿瘤患者中,合并的类固醇难治性结肠炎/腹泻比率分别为49%和34%(Pinteraction = 0.24);首次输注ICIs与发生结肠炎/腹泻症状的中位时间间隔<49天和≥49天的研究中,合并的类固醇难治性结肠炎/腹泻比率分别为35%和59%(Pinteraction = 0.34);接受内镜评估的患者数量<30和≥30的研究中,合并的类固醇难治性结肠炎/腹泻比率分别为52%和35%(Pinteraction = 0.30);中位随访时间<14个月和≥14个月的研究中,合并的类固醇难治性结肠炎/腹泻比率分别为59%和45%(Pinteraction = 0.58)。Meta回归分析未发现异质性的来源。研究间存在显著的发表偏倚(P = 0.040)。
3.4 对生物制剂治疗的应答
15项研究报道了489例ICIs相关结肠炎/腹泻患者对生物制剂治疗的应答率。结果显示,合并的生物制剂应答率为96%(95% CI:87%-100%),各研究间存在显著异质性(I² = 81.34%,P < 0.01)。亚组分析显示,低质量研究和高质量研究中,合并的生物制剂应答率分别为64%和97%(Pinteraction < 0.01);黑色素瘤和混合类型肿瘤患者中,合并的生物制剂应答率分别为97%和95%(Pinteraction = 0.72);首次输注ICIs与发生结肠炎/腹泻症状的中位时间间隔<49天和≥49天的研究中,合并的生物制剂应答率分别为91%和97%(Pinteraction = 0.35);接受内镜评估的患者数量<30和≥30的研究中,合并的生物制剂应答率分别为100%和89%(Pinteraction = 0.24);中位随访时间<14个月和≥14个月的研究中,合并的生物制剂应答率分别为98%和91%(Pinteraction = 0.23)。Meta回归分析结果显示,异质性可能来源于研究质量。研究间存在显著的发表偏倚(P = 0.020)。
4.死亡率
27项研究报道了ICIs相关结肠炎/腹泻患者的死亡率。结果显示,合并的死亡率为2%(95% CI:0%-5%),各研究间存在显著异质性(I² = 92.09%,P < 0.01)。亚组分析显示,低质量研究和高质量研究中,合并的死亡率分别为3%和1%(Pinteraction = 0.56);黑色素瘤和混合类型肿瘤患者中,合并的死亡率分别为0%和3%(Pinteraction = 0.08);首次输注ICIs与发生结肠炎/腹泻症状的中位时间间隔<49天和≥49天的研究中,合并的死亡率分别为1%和0%(Pinteraction = 0.09);接受内镜评估的患者数量<30和≥30的研究中,合并的死亡率分别为1%和3%(Pinteraction = 0.85);中位随访时间<14个月和≥14个月的研究中,合并的死亡率分别为0%和5%(Pinteraction = 0.17);接受皮质类固醇治疗和皮质类固醇联合生物制剂治疗的患者中,合并的死亡率分别为3%和1%(Pinteraction = 0.79)。Meta回归分析结果显示,异质性可能来源于地区。研究间未发现显著的发表偏倚(P = 0.407)。
5.ICIs的管理
5.1 ICIs的永久停药
6项研究报道了ICIs相关结肠炎/腹泻患者ICIs永久停药的情况。结果显示,ICIs永久停药的合并发生率为43%(95% CI:9%-82%),各研究间存在显著异质性(I² = 98.74%,P < 0.01)。亚组分析显示,低质量研究和高质量研究中,ICIs永久停药的合并发生率分别为3%和58%(Pinteraction < 0.01);黑色素瘤和混合类型肿瘤患者中,ICIs永久停药的合并发生率分别为54%和28%(Pinteraction < 0.01);首次输注ICIs与发生结肠炎/腹泻症状的中位时间间隔<49天和≥49天的研究中,ICIs永久停药的合并发生率分别为14%和74%(Pinteraction < 0.01);接受内镜评估的患者数量<30和≥30的研究中,ICIs永久停药的合并发生率分别为50%和37%(Pinteraction = 0.69)。Meta回归分析未发现异质性的来源。研究间未发现显著的发表偏倚(P = 0.884)。
5.2 ICIs的重新启用
10项研究报道了ICIs相关结肠炎/腹泻患者ICIs重新启用的情况。结果显示,ICIs重新启用的合并发生率为33%(95% CI:11%-60%),各研究间存在显著异质性(I² = 98.60%,P < 0.01)。亚组分析显示,低质量研究和高质量研究中,ICIs重新启用的合并发生率分别为28%和35%(Pinteraction = 0.69);黑色素瘤和混合类型肿瘤患者中,ICIs重新启用的合并发生率分别为29%和36%(Pinteraction = 0.75);首次输注ICIs与出现结肠炎/腹泻症状的中位时间间隔<49天和≥49天的研究中,ICIs重新启用的合并发生率分别为64%和25%(Pinteraction = 0.22);接受内镜评估的患者数量<30和≥30的研究中,ICIs重新启用的合并发生率分别为18%和48%(Pinteraction = 0.16);中位随访时间<14个月和≥14个月的研究中,ICIs重新启用的合并发生率分别为24%和31%(Pinteraction = 0.48);接受皮质类固醇治疗和皮质类固醇联合生物制剂治疗的患者中,ICIs重新启用的合并发生率分别为36%和34%(Pinteraction = 0.91)。Meta回归分析未发现异质性的来源。研究间未发现显著的发表偏倚(P = 0.555)。
总结与展望
根据我们的系统评价和荟萃分析,接受ICIs治疗的癌症患者中,结肠炎/腹泻很常见,但在短期随访期间很少致死。一半的患者对一线皮质类固醇治疗有应答,另一半无应答。相比之下,生物制剂在类固醇难治性结肠炎/腹泻的患者中应答率高。需进一步确立和完善ICIs相关结肠炎/腹泻的最佳管理策略。


