CSCO 2023 |《ICIs临床应用指南2023版》更新解读(下)
时间:2023-04-25 10:21:54 热度:37.1℃ 作者:网络
来源:找药宝典
为积极推动我国临床肿瘤学事业的发展、提高临床肿瘤医师的临床与科研水平,进一步促进CSCO诊疗指南的制定和推广,由中国临床肿瘤学会和北京市希思科临床肿瘤学研究基金会联合主办的2023年CSCO指南会于4月21-22日在广州隆重召开。大会开设多个专场,一众学术大咖对指南的更新要点、指南推荐建议进行解读。在免疫治疗专场,空军军医大学西京医院肿瘤科主任 张红梅教授对《ICIs临床应用指南2023版》下半部分更新进行了解读。

《ICIs临床应用指南2023版》——更新解读(下部分)
由空军军医大学西京医院肿瘤科主任 张红梅教授从肾癌、尿路上皮癌、宫颈癌、复发或转移性子宫内膜癌、复发或难治性卵巢癌、黑色素瘤、复发/难治性恶性淋巴瘤、皮肤癌(非黑色素瘤)、MSI-H/dMMR和TMB-H实体瘤多个癌种的角度,更新解读了《ICIs临床应用指南2023版》。
11. 肾癌
更新内容
* 标题由“晚期肾癌”改为“肾癌”
* 新增肾透明细胞癌新辅助治疗,将“阿维鲁单抗+阿昔替尼(仅适用于高复发风险患者)”列为Ⅲ级推荐
* 新增肾透明细胞癌辅助治疗,将“帕博利珠单抗(仅适用于高复发风险患者)”列为Ⅰ级推荐
* “帕博利珠单抗+阿昔替尼”升级为晚期肾透明细胞癌一线治疗(低风险组)Ⅰ级推荐
* 新增“纳武利尤单抗+伊匹木单抗”为晚期肾透明细胞癌一线治疗(低风险组)Ⅱ级推荐
* 新增“仑伐替尼+帕博利珠单抗”为晚期肾透明细胞癌二线及以上治疗Ⅱ级推荐
* 新增“纳武利尤单抗+卡博替尼”为晚期肾透明细胞癌二线及以上治疗Ⅲ级推荐

更新证据
1.在新辅助治疗中将阿维鲁单抗+阿昔替尼(仅适用于高复发风险患者)纳入Ⅲ级推荐是基于NeoAvAx研究,这是一项Ⅱ期、单臂、单中心、开放标签临床研究。高危非转移性肾透明细胞癌(cT1b-4cN0-1MO,3-4级)患者在肾切除术前接受阿维鲁单抗+阿昔替尼治疗12周。主要终点:按照RECIST 1.1标准,原发性肿瘤(PT)的部分缓解率(PR)≥25%;次要终点:DFS、OS和安全性。
该研究40例患者结果分析显示,有12例PR(30%),原发肿瘤中位缩小20%;中位随访23.5个月,32%患者复发;次要终点DFS及OS尚未达到。

2.在辅助治疗中将帕博利珠单抗(高复发风险患者)列为Ⅰ级推荐是基于KN564研究。KEYNOTE-564是一项多中心、随机、双盲、安慰剂对照研究,对比帕博利珠单抗和安慰剂辅助治疗根治性肾癌术且具高复发风险患者的疗效。该研究纳入994例患者,辅助治疗持续1年;经30月随访,帕博利珠单抗组和安慰剂组24个月的DFS率分别为77.3%和68.1%,两组间差异有统计学意义;亚组分析提示中高危、高危以及转移灶术后无瘤的患者均能从辅助免疫治疗获益。
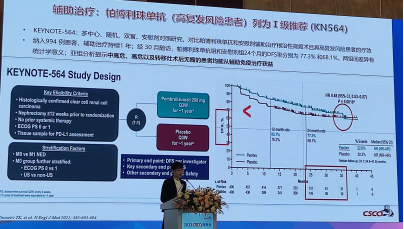
3.将帕博利珠单抗+阿昔替尼升级为晚期肾透明细胞癌一线治疗(低风险组)Ⅰ级推荐是基于KEYNOTE-426研究,KEYNOTE-426研究是一项帕博利珠单抗联合阿昔替尼与舒尼替尼对照,用于晚期或转移性肾透明细胞癌治疗的随机、开放标签的Ⅲ期临床研究。在861例既往未接受治疗的进展期ccRCC患者中,接受阿昔替尼+帕博利珠单抗联合治疗组12个月OS率显著优于舒尼替尼组(89.9%vs78.3%),中位PFS 15.4个月vs.11.1个月。截至2020年12月,联合治疗组中位OS显著优于舒尼替尼单药组(未达到vs.33.3月)。
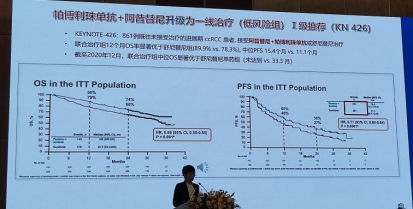
4.新增纳武利尤单抗+伊匹木单抗为晚期肾透明细胞癌一线治疗(低风险组)Ⅱ级推荐的证据基于CheckMate 214研究和CheckMate 016研究。
在CheckMate 214研究中纳入249例低风险肾癌患者,125例接受纳武利尤单抗联合伊匹木单抗治疗,124例接受舒尼替尼治疗。虽然结果显示低风险者联合治疗18个月OS率、PFS和ORR均劣于舒尼替尼,18个月OS率分别为88% vs 93%;ORR为29% vs 52%;PFS为14.3个月 vs 25.1个月。但是,纳武利尤单抗联合伊匹木单抗组CR率更高(11% vs 6%)。
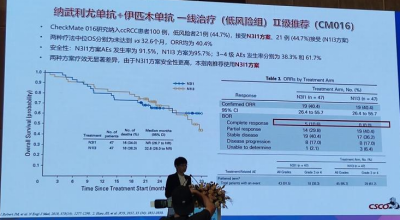
CheckMate 016研究纳入ccRCC患者100例,低风险者21例(44.7%)接受N3I1方案,21例(44.7%)接受N1I3方案。两种疗法中位0S分别为 未达到vs 32.6个月,ORR均为40.4%。在安全性方面,N3I1方案AEs发生率为91.5%,N1I3方案为95.7%;3~4级AEs发生率分别为38.3%和61.7%。两种方案疗效无显著差异,由于N3I1方案安全性更高,本指南推荐使用N3I1方案。
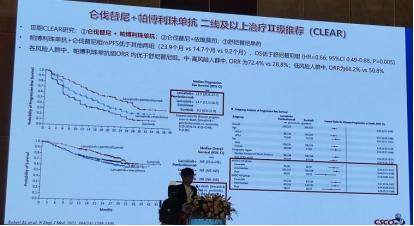
5.新增仑伐替尼+帕博利珠单抗为晚期肾透明细胞癌二线及以上治疗Ⅱ级推荐是基于CLEAR研究。CLEAR研究是一项探讨仑伐替尼联合帕博利珠单抗或依维莫司对比舒尼替尼作为晚期肾细胞癌患者一线治疗Ⅲ期试验。研究结果显示:帕博利珠单抗+仑伐替尼组mPFS优于其他两组(23.9个月vs 14.7个月vs 9.2个月),OS优于舒尼替尼组(HR=0.66;95%C1 0.49-0.88,P=0.005)。各风险人群中,帕博利珠单抗组ORR均优于舒尼替尼组。中-高风险人群中ORR为72.4% vs 28.8%;低风险人群中ORR为68.2% vs 50.8%。
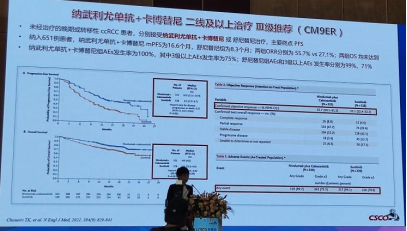
6.新增纳武利尤单抗+卡博替尼为晚期肾透明细胞癌二线及以上治疗Ⅲ级推荐是基于CheckMate 9ER研究。CheckMate 9ER临床研究是一项随机Ⅲ期临床研究,未经治疗的晚期或转移性ccRCC患者分别接受纳武利尤单抗+卡博替尼或舒尼替尼治疗。主要终点为PFS。
纳入651例患者中,接受纳武利尤单抗+卡博替尼联合治疗的mPFS为16.6个月,舒尼替尼组为8.3个月;两组ORR分别为55.7% vs 27.1%;两组OS均未达到。
纳武利尤单抗+卡博替尼组AEs发生率为100%,其中3级以上AEs发生率为75%;舒尼替尼组AEs和3级以上AEs发生率分别为99%、71%。
12.尿路上皮癌
更新内容
* 删除“阿替利珠单抗”晚期尿路上皮癌一线治疗Ⅲ级推荐
* 删除“阿替利珠单抗”“度伐利尤单抗”晚期尿路上皮癌二线及以上治疗Ⅲ级推荐
* 新增“卡瑞利珠单抗”为晚期尿路上皮癌二线及以上治疗Ⅲ级推荐
更新证据
1.删除阿替利珠单抗晚期尿路上皮癌一线治疗Ⅲ级推荐是基于Imvigor 130研究。虽然 2017年4月基于Imvigor210(Cohort 1),FDA有条件批准阿替利珠单抗一线治疗晚期尿路上皮癌,但Imvigor 130未达预设OS,阿替利珠单抗治疗晚期尿路上皮癌一线适应证折戟。
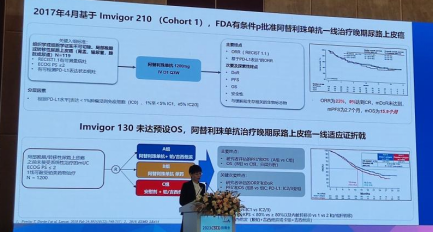
2.删除“阿替利珠单抗”“度伐利尤单抗”晚期尿路上皮癌二线及以上治疗Ⅲ级推荐是由于Imvigor 211研究。基于1108研究及Imvigor 210(Cohort2)数据,FDA有条件批准度伐利尤单抗、阿替利珠单抗二线治疗晚期UC。基于Imvigor211 PD-L1高表达患者,与化疗相比,阿替利珠单抗并未显著延长0S。

3.新增卡瑞利珠单抗二线及以上治疗Ⅲ级推荐是基于NCT03827837研究,这是一项卡瑞利珠单抗+法米替尼治疗晚期尿路上皮癌Ⅱ期临床研究。入组36例患者结果分析结果显示中位随访时间11.9个月,ORR为30.6%,DoR为6.3个月,mPFS为4.1个月,OS为12.9个月。膀胱尿路上皮癌患者(n=18),ORR为38.9%,mPFS为8.3个月,中位DoR和OS未达到。

13.宫颈癌
更新内容
* 新增“卡度尼利单抗”为晚期宫颈癌二线及以上治疗Ⅰ级推荐。
更新证据
基于AK104-201研究,该研究旨在评估卡度尼利单抗二线治疗复发/转移性宫颈癌的疗效。入组患者为既往含铂化疗失败的复发或转移性宫颈癌患者。截至2021年8月5日,中国36家中心共111例晚期宫颈癌患者入组ORR为33%,CR率为12%,PR率为21%,mPFS为3.75个月,mOS为17.51个月。无论PD-L1状态、是否接受过贝伐珠单抗,患者均能从卡度尼利单抗单药治疗获益。

14.复发或转移性子宫内膜癌
更新内容
* 新增“替雷利珠单抗(限MSI-H/dMMR患者)”为Ⅲ级推荐
更新证据
基于RATIONALE 209研究,该研究旨在评估替雷利珠单抗用于经治MSI-H/dMMR实体瘤患者的疗效和安全性,包括13例子宫内膜癌患者。替雷利珠单抗单药治疗子宫内膜癌患者ORR达到46.2%(6/13),CR率为23.1%(3/13),DCR为53.8%(7/13)。

15.复发或难治性卵巢癌
更新内容
* 将本章标题由“复发性卵巢癌”改为“复发或难治性卵巢癌”
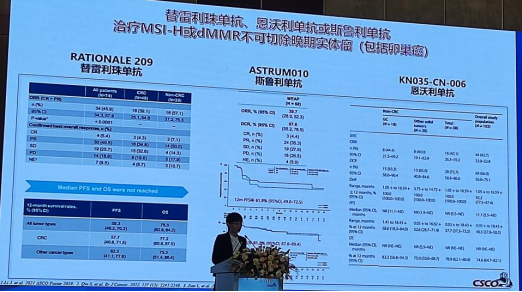
* 新增“替雷利珠单抗、恩沃利单抗和斯鲁利单抗(限MSI-H/dMMR患者)”
为Ⅲ级推荐
更新证据
替雷利珠单抗、斯鲁利单抗、恩沃利单抗分别基于RATIONALE 209研究、ASTRUM010研究、KN035-CN-006研究。
16.黑色素瘤
更新内容
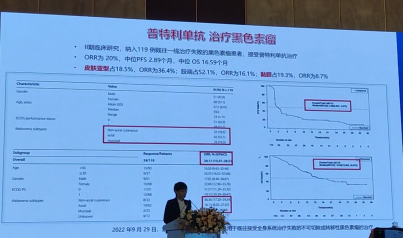
* 新增“普特利单抗”为晚期皮肤黑色素瘤二线治疗I级推荐
* 新增“普特利单抗”为晚期黏膜黑色素瘤一线或以上治疗Ⅲ级推荐
更新证据
普特利单抗治疗黑色素瘤是基于一项Ⅱ期临床研究,纳入119例既往一线治疗失败的黑色素瘤患者,接受普特利单抗治疗。结果显示ORR为20%,中位PFS为2.89个月,中位OS为16.59个月。皮肤亚型占18.5%,ORR为36.4%;肢端占52.1%,ORR为16.1%;黏膜占19.3%,ORR为8.7%。
17.复发/难治性恶性淋巴瘤
更新内容
* 新增“帕博利珠单抗+吉西他滨+长春瑞滨+脂质体阿霉素”“纳武利尤单抗+异环磷酰胺+依托泊苷+卡铂”“纳武利尤单抗+维布妥昔单抗+苯达莫司汀"为经典型霍奇金淋巴瘤Ⅲ级推荐。
更新证据
1.帕博利珠单抗+吉西他滨+长春瑞滨+脂质体阿霉素为经典型霍奇金淋巴瘤Ⅲ级推荐基于一项评估帕博利珠单抗+吉西他滨、长春瑞滨、脂质体阿霉素(GVD)作为复发或难治性cHL的二线治疗Ⅱ期研究。38例可评估患者,联合治疗的ORR和CR率分别为100%和95%。
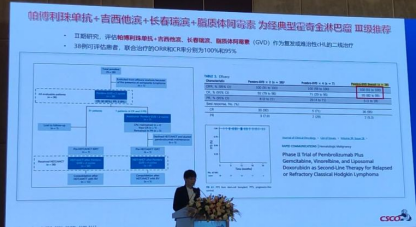
2.纳武利尤单抗或联合异环磷酰胺、卡铂和依托泊苷为经典型霍奇金淋巴瘤Ⅲ级推荐是基于一项评估纳武利尤单抗单独或联合异环磷酰胺、卡铂和依托泊苷(ICE)作为复发/难治性cHL的首次挽救治疗和自体造血细胞移植桥接治疗的Ⅱ期研究。
患者43例(34例单药,9例联合),42例可评估反应。纳武利尤单抗治疗后的ORR为81%,CR率为71%。9例联合治疗的患者全部有效,其中8例(89%)达CR;在方案治疗结束时,ORR和CR率分别为93%和91%。
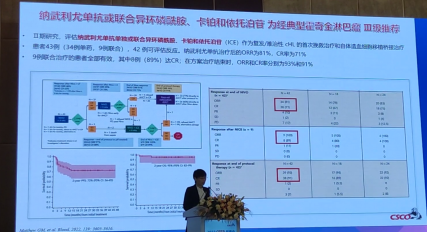
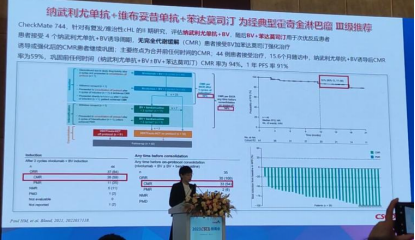
3.纳武利尤单抗+维布妥昔单抗+苯达莫司汀为经典型霍奇金淋巴瘤Ⅲ级推荐基于CheckMate 744研究,该研究是一项针对有复发/难治性cHL的Ⅱ期研究,评估纳武利尤单抗+BV,随后BV+苯达莫司汀用于次优反应患者。患者接受4个纳武利尤单抗+BV诱导周期,无完全代谢缓解(CMR)患者接受BV加苯达莫司汀强化治疗。诱导或强化后的CMR患者继续巩固;主要终点为合并前任何时间的CMR;44例患者接受治疗,15.6个月随访中,纳武利尤单抗+BV诱导后CMR率为59%,巩固前任何时间(纳武利尤单抗+BV±BV+苯达莫司汀)CMR率为94%,1年PFS率91%。
18.皮肤癌(非黑色素瘤)

19.MSI-H/dMMR和TMB-H实体瘤
更新内容
* 新增MSI-H/dMMR结直肠癌新辅助免疫治疗,并将“纳武利尤单抗+伊匹木单抗”列为Ⅱ级推荐
* 新增“替雷利珠单抗”、“斯鲁利单抗”和“普特利单抗”为MSI-H/dMMR晚期结直肠癌和晚期实体瘤二线及以上治疗I级推荐。
更新证据
1.MSI-H/dMMR结直肠癌新辅助中纳武利尤单抗+伊匹木单抗列为Ⅰ级推荐基于NIHCE-2研究,该研究纳入112例cT3以上或N+dMMR结肠癌患者,术前接受1周期纳武利尤单抗+伊匹木单抗及1周期纳武利尤单抗后手术63%患者为T4a和T4b。结果提示,MPR率为95%,pCR率为67%,RO切除率100%。
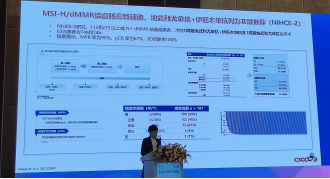
2.替雷利珠单抗为MSI-H/dMMR晚期结直肠癌和晚期实体瘤二线及以上治疗Ⅰ级推荐基于RATIONALE 209研究,纳入74例MSI-H或dMMR晚期实体瘤患者,其中结直肠癌62.2%、子宫内膜癌17.6%、胃/胃食管结合部癌10.8%、小肠腺癌4.1%,所有受试者ORR为45.9%,DCR为71.6%,12个月PFS率为59.3%,0S率为75.3%,安全性良好。

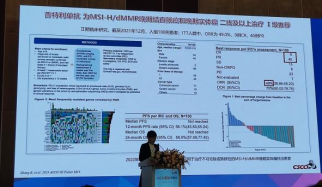
3.斯鲁利单抗为MSI-H/dMMR晚期结直肠癌和晚期实体瘤二线及以上治疗Ⅰ级推荐基于ASTRUM010研究,纳入68例MSI-H或dMMR成人晚期实体瘤,结直肠癌77.9%、子宫内膜癌7.4%、胃/胃食管结合部癌5.9%,所有受试者ORR为39.7%,DCR为67.6%,12个月PFS率为61.9%,OS率为81.2%,安全性良好。
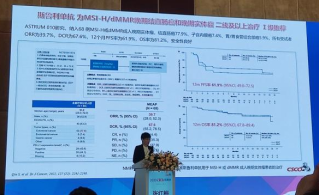
4.普特利单抗为MSI-H/dMMR晚期结直肠癌和晚期实体瘤二线及以上治疗Ⅰ级推荐基于一项Ⅱ期临床研究,截至2021年12月,入组100例患者;ITT人群中,ORR为49.0%,9例CR,40例PR。
随着临床试验广泛开展和证据成熟,多个ICI新增应用推荐,部分推荐进行升级,少部分推荐被移除。多个国产ICIs陆续获批用于临床,丰富了免疫治疗的选择。
联合免疫治疗不断丰富,包括免疫联合抗血管生成、双免疫联合等,双特异性抗体获批宫颈癌治疗。免疫治疗在部分瘤种新增新辅助治疗、辅助治疗的临床应用推荐,如肾透明细胞癌、结直肠癌等。


