【论著】| FAM19A4、PAX1及miRNA124-2基因启动子区甲基化在宫颈病变早期诊断中的价值
时间:2024-09-26 15:00:34 热度:37.1℃ 作者:网络
[摘要] 背景与目的:目前有关宫颈病变的DNA甲基化研究较多,但DNA甲基化作为宫颈病变的诊断及分流指标在临床实践中的报道较少。本研究拟探讨FAM19A4、PAX1及miRNA124-2基因启动子区甲基化在宫颈病变进展中早期诊断的价值。方法:收集2020年3月—2022年3月在郑州大学第三附属医院同时行宫颈液基细胞学(thinprep cytologic test,TCT)和HPV检测的患者的宫颈细胞学标本共129例,采用甲基化特异性PCR(methylation-specific PCR,MSP)检测不同宫颈病变中FAM19A4、PAX1及miRNA124-2基因启动子区甲基化改变情况,采用受试者工作特征(receiver operating characteristic,ROC)曲线评估3个基因甲基化改变对宫颈病变的诊断价值。本研究经郑州大学第三附属医院伦理委员会批准(伦理审批编号:2023-135-01)。结果:根据病理学检查结果分为4组:未见上皮内病变或恶性细胞(no intraepithelial lesions or malignant lesions,NILM)组(42例)、低度鳞状上皮内病变(low grade squamous intraepithelial lesion,LSIL)组(28例)、高度鳞状上皮内病变(high grade squamous intraepithelial lesion,HSIL)组(36例)和鳞癌(squamous cervical cancer,SCC)组(23例)。随宫颈病变级别的增加,FAM19A4、PAX1及miRNA124-2基因甲基化检出率逐步增高,差异有统计学意义(P均<0.05)。在HSIL组FAM19A4、PAX1、miRNA124-2甲基化检出率分别为81.2%、80.5%和71.8%,在SCC组3种基因甲基化检出率均高达100.0%;细胞学诊断宫颈癌的ROC曲线下面积(area under curve,AUC)为0.731,诊断灵敏度和特异度分别为65.9%和80.4%;FAM19A4、PAX1及miRNA124-2基因单独诊断HSIL+(HSIL和SCC)时,PAX1甲基化诊断HSIL+的效能最高,AUC为0.925,灵敏度为92.8%,特异度为87.3%;两两联合诊断时,FAM19A4与PAX1联合诊断HSIL+的AUC为0.930,灵敏度为95.7%,特异度为87.1%;FAM19A4与miRNA124-2联合诊断HSIL+,AUC为0.895,灵敏度为97.6%,特异度为85.7%;PAX1联合miRNA124-2诊断HSIL+,AUC为0.928,灵敏度为95.7%,特异度为89.1%;PAX1、FAM19A4及miRNA124-2基因甲基化联合诊断HSIL+,AUC为0.928,灵敏度为100.0%,特异度为81.8%。 结论:FAM19A4、PAX1及miRNA124-2基因启动子区甲基化诊断宫颈病变具有较高的灵敏度和特异度,有潜力成为宫颈病变早期诊断的新指标。
[关键词]FAM19A4;PAX1;miRNA124-2;甲基化;宫颈病变
[Abstract] Background and purpose: At present, there have been many reports on the study of methylation in cervical lesions, however it is still not clinically practical as a diagnostic and shunting index of cervical lesions. In this study, we intended to investigate the early diagnostic value of FAM19A4, PAX1 and miRNA124-2 methylation in promoter region in the progression of cervical lesions. Methods: A total of 129 liquid-based cytology specimens of different grades of cervical lesions diagnosed in the Third Affiliated Hospital of Zhengzhou University from Mar. 2020 to Mar. 2022. Methylation specific PCR (MSP) was used to detect the methylation changes of FAM19A4, PAX1 and miRNA124-2 genes in different cervical lesions. Receiver operating characteristic (ROC) curve was used to evaluate the diagnostic value of methylation changes of the three genes in cervical lesions. This study was approved by the Ethics Committee of the Third Affiliated Hospital of Zhengzhou University (No. 2023-135-01). Results: All the specimens were collected and divided into 4 groups according to the histological results: 42 cases of no intraepithelial lesions or malignant lesions (NILM), 28 cases of low grade squamous intraepithelial lesion (LSIL), 36 cases of high grade squamous intraepithelial lesion (HSIL), 23 cases of squamous cervical cancer (SCC). With the increase in the level of cervical lesions, FAM19A4, PAX1 and miRNA124-2 gene methylation detection rates increased gradually, and the differences were statistically significant (P<0.05). The methylation detection rates of FAM19A4, PAX1 and miRNA124-2 in HSIL group were 81.2%, 80.5% and 71.8%, respectively, and the methylation detection rates of three genes in SCC group were up to 100.0%. Cytological diagnosis of cervical cancer showed the area under curve (AUC) was 0.731, with a sensitivity and a specificity of 65.9% and 80.4%, respectively. When FAM19A4, PAX1 and miRNA124-2 were used alone to diagnose HSIL+ (HSIL and SCC), PAX1 methylation had the highest diagnostic efficiency, and the AUC was 0.925, with a sensitivity and a specificity of 92.8% and 87.3% . When the diagnosis was made in pairs, the AUC of FAM19A4 combined with PAX1 in the diagnosis of HSIL+ was 0.930, with a sensitivity and a specificity of 95.7% and 87.1%, respectively. The AUC of FAM19A4 combined with miRNA124-2 in the diagnosis of HSIL+ was 0.895, with a sensitivity and a specificity of 97.6% and 85.7%, respectively. The AUC of PAX1 combined with miRNA124-2 in the diagnosis of HSIL+ was 0.928, with a sensitivity and a specificity of 95.7% and 89.1%, respectively. When the PAX1 and FAM19A4 combined with miRNA124-2 in the diagnosis of HSIL+, the AUC was 0.928, with a sensitivity and a specificity of 100.0% and 81.8%, respectively. Conclusion: The methylation of the promoter regions of the FAM19A4, PAX1 and miRNA124-2 genes demonstrates high sensitivity and specificity in diagnosing cervical lesions, indicating the potential for becoming novel indicators for early diagnosis of cervical lesions.
[Keywords]FAM19A4; PAX1; miRNA124-2; Methylation; Cervical lesion
宫颈癌严重威胁女性健康。尽管宫颈癌筛查及疫苗接种已在临床应用多年,但宫颈癌的防治效果却不尽如人意。近十年来,中国宫颈癌的发病趋势及死亡趋势呈现明显的年轻化和上升趋势[1]。2021年1月,中国首次多中心大样本子宫颈癌筛查随机对照临床研究报告显示,2020年全球范围内宫颈癌新发病例达60.4万,死亡34.2万。而中国罹患宫颈癌人数居全球首位,高达10.6万例[2],中国宫颈癌的防治工作任重道远。高危型人乳头状瘤病毒(human papilloma virus,HPV)持续感染是宫颈癌发生的重要危险因素。但研究[3]显示,90%的HPV可被宿主免疫系统清除,高危型HPV感染是宫颈癌发生、发展的必要但非充分条件,提示还有其他重要因素参与宫颈癌的恶性转化过程[4]。目前中国宫颈癌筛查的主要方法为细胞学检查和(或)高危型HPV检测。虽然宫颈细胞学检测特异性高,但敏感性低,同时受病理科医师技术水平和经验的影响,存在较大的主观差异;尽管HPV检测较细胞学筛查的灵敏度更高,但特异度却较低[5]。可见,目前的宫颈癌筛查手段均具有其局限性,尚不能在早期精确诊断宫颈病变及预测其进展趋势。因此,进一步研究高危型HPV感染后导致宫颈癌发生的分子生物学机制,发现新的宫颈癌筛查诊断标志物,实现对有宫颈癌前病变的高危妇女进行精准诊断和干预治疗,是目前宫颈癌诊疗亟待解决的问题[6]。表观遗传学(epigenetics)是指在DNA序列不改变的前提下,发生可遗传的基因表观变化,是宫颈癌发病的重要因素,主要包括组蛋白质修饰、RNA干扰、DNA甲基化等[7]。其中DNA甲基化是目前备受关注的表观遗传修饰方式之一,也是目前研究的热点[8]。
FAM19A4从属于TAFA基因家族,它通过编码一种具有正向调控巨噬细胞免疫功能的分泌蛋白,进而调控炎症反应及应激反应,在机体对抗肿瘤发生、发展中起到免疫防御的作用。有研究[9]发现,FAM19A4基因启动子甲基化水平与宫颈病变程度呈正相关,具有抑癌功能的基因FAM19A4启动子CpG岛发生甲基化将导致基因沉默,尤其是在宫颈癌中。但目前有关FFAM19A4基因启动子甲基化的相关报道较少。PAX1是一种普遍存在于脊椎动物体内的转录因子,从属于配对盒基因家族,是一种重要的转录因子,主要功能是参与细胞内信号转导,抑制细胞内基因转录进程,参与细胞的分化、更新及凋亡,是一种重要的抑癌基因[9]。有研究[11]提示,宫颈癌细胞中PAX1基因甲基化程度普遍高于正常宫颈组织及低级别宫颈病变,这为PAX1成为宫颈病变的筛查诊断指标提供了可能。 microRNA-124-2(miRNA124-2或miR124-2)是参与转录后基因表达调控的非编码单链RNA,它参与细胞周期调控,同时也参与调节炎症反应相关基因表达[12]。有研究[13]报道,在恶性肿瘤中miRNA124-2的表达水平与癌症发展有相关关系,有望成为癌症诊断及靶向治疗的标志物。
尽管关于宫颈病变的DNA甲基化研究已有不少报道,但作为宫颈病变的诊断及分流指标仍然缺乏临床实用性。因此,联合筛查多个宿主基因的甲基化改变,构建宫颈病变的早期精准诊断模型,从而提高宫颈癌筛查的灵敏度和特异度,具有一定的临床应用价值,也是现阶段研究的重中之重。本研究分别立足于机体防御、抑癌基因及microRNA调控三个维度,分别选取FAM19A4、PAX1及miRNA124-2基因,通过检测其启动子区甲基化在不同级别宫颈病变中的改变,探讨3个基因启动子区甲基化改变在预测宫颈病变进展及早期诊断中的价值。
1 资料和方法
1.1 研究对象
收集2020年3月—2022年3月在郑州大学第三附属医院同时行宫颈液基细胞学(thinprep cytologic test,TCT)和HPV检测患者的宫颈细胞学标本,并追踪其病理学检查结果及相关临床信息,并以病理学检查结果为金标准进行分组。纳入标准:① 年龄18~70岁女性;② 有过性生活且取样时未处于月经期及孕期;③ 未合并其他恶性肿瘤及肿瘤转移;④ 就诊前7日内未行阴道内用药和阴道冲洗治疗,取样前3天未同房、盆浴及妇科检查;⑤ 自愿接受宫颈HPV、TCT筛查和阴道镜检查及活组织病理学检查。排除标准:① 急性或慢性阴道炎;② 两个月内接受放化疗及其他物理治疗;③ 先天性子宫畸形;④ 既往宫颈手术或子宫切除史;⑤ 合并其他恶性肿瘤或肿瘤转移。所有细胞学标本收集后用处理液进行密度梯度离心,尽可能去除白细胞干扰,分离出的宫颈上皮细胞放入液氮罐中保存。所有入选患者均无全子宫切除史、放化疗史及手术史等。该研究经郑州大学第三附属医院伦理委员会批准(伦理审批编号:2023-135-01)。
1.2 HPV检测
HPV检测采用人乳头状瘤病毒(23个型)核酸分型检测试剂盒,包含了甲基化特异性PCR (methylation-specific PCR,MSP)扩增试剂和杂交分型检测试剂。HPV检测型别包括HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68、6、11、42、43、44、53、81、73、82型,严格按照标准化取样要求规范取样:要求被检查者3 d内无性生活史,阴道无灌洗及上药。取膀胱截石位,检查者使用窥阴器充分暴露被检查者的阴道及宫颈,用棉签擦拭宫颈上的白带等分泌物,将宫颈专用刷缓慢深入到宫颈口内,顺时针旋转3 ~ 5圈,将宫颈刷放入HPV试管中保存拧紧瓶盖,贴好标签并及时送检。
1.3 TCT检测
要求被检查者3 d内无性生活史,7 d内阴道无灌洗及上药。严格按照规范化取样流程取样,贴好标签并及时送检。TCT结果判读,由本院病理科三名专科细胞病理学医师根据2014年版宫颈细胞学Bsthesda系统(The Bsthesda System,TBS)标准进行诊断。如果3位医师诊断意见不一致,请高年资病理学专家会诊,并作为疑难病例在科室内部进行讨论,结合患者HPV结果进行细胞学判读,并追踪活检结果与细胞学诊断进行对照。
1.4 DNA甲基化检测
采用广州安必平医药科技股份有限公司生产的FAM19A44基因甲基化检测试剂盒、PAX1基因甲基化检测试剂盒及miRNA124-2基因甲基化检测试剂盒,检测不同级别宫颈脱落细胞标本中FAM19A4基因、PAX1基因及miRNA124-2基因甲基化情况,操作严格按说明书进行。
1.5 阴道镜活检及病理学诊断
严格按照阴道镜检查及活检操规范进行取样,并由本院三名病理学专家进行显微镜下阅片诊断。宫颈病变组织病理学分类参照2020年世界卫生组织(World Health Organization,WHO)分类标准女性生殖系统肿瘤分类中鳞状上皮肿瘤分类标准进行分组。
1.6 统计学处理
采用SPSS 21.0软件进行统计学处理。计量资料采用x±s表示,组间比较采用单因素方差分析,进一步两两比较采用Bonferroni法。计数资料组间比较采用χ2检验,进一步两两比较采用Bonferroni法。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价基因甲基化对宫颈病变的诊断效能。P<0.05为差异有统计学意义。
2 结 果
2.1 临床基本信息比较
以病理学检查结果为金标准,将患者进行分组。最终筛选出129例符合要求的宫颈细胞学样本并分为4组:其中未见上皮内病变或恶性细胞(no intraepithelial lesions or malignant lesions,NILM)组(42例),低度鳞状上皮内病变(low grade squamous intraepithelial lesion,LSIL)组28例,高度鳞状上皮内病变(high grade squamous intraepithelial lesion,HSIL)组36例,鳞癌(squamous cervical cancer,SCC)组23例。各组患者年龄分为(37.0±11.58)、(40.9±12.27)、(42.8±9.84)和(53.4±12.69)岁。随宫颈病变程度的增加,平均患病年龄呈上升趋势,且SCC组年龄显著高于NILM、LSIL和HSIL组(P 均<0.05), NILM、LSIL、HSIL组患者的年龄差异无统计学意义(P均>0.05)。NILM、LSIL、HSIL和SCC组的HPV感染率分别为47.6%、89.3%、97.2%和91.3%,组间比较差异有统计学意义(P<0.05,表1)。
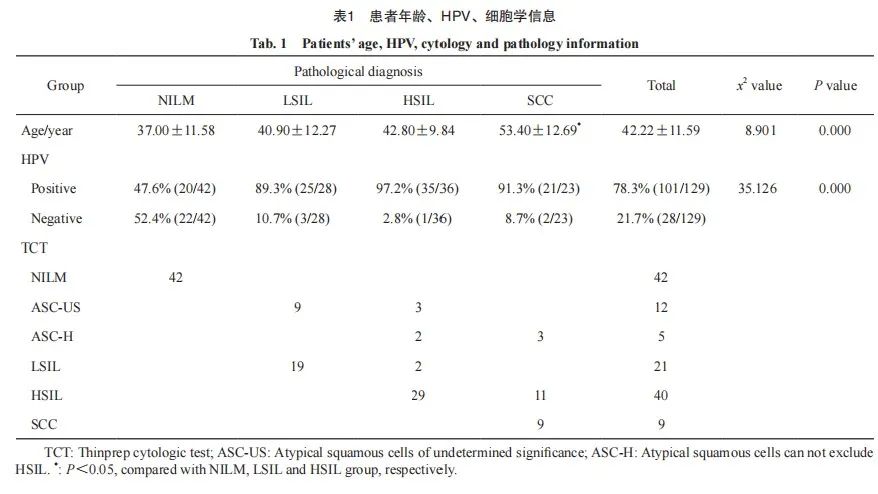
2.2 FAM19A4、PAX1及miRNA124-2基因在不同级别宫颈病变中的甲基化改变情况
FAM19A4、PAX1、miRNA124-2基因甲基化检出率均随宫颈病变级别的增加呈增高趋势。PAX1基因启动子区甲基化检出率在NILM、LSIL、HSIL及SCC组分别为21.4%、35.7%、80.5%和100.0%,4组间差异有统计学意义(P <0.05)。进一步两两比较:NILM和LSIL、HSIL和SCC组间差异无统计学意义(P均>0.05);NILM和HSIL、NILM和SCC、 LSIL和HSIL、LSIL和SCC组差异有统计学意义(P<0.05)。miRNA124-2基因启动子区甲基化检出率在NILM、LSIL、HSIL及SCC组分别为 28.5%、29.6%、71.8%和100.0%,各组间差异有统计学意义(P<0.05)。其中NILM和LSIL、HSIL和SCC组间差异无统计学意义(P均>0.05);NILM和HSIL、NILM和SCC、 LSIL和HSIL、LSIL和SCC组差异有统计学意义(P均<0.05)。
FAM19A4基因启动子区甲基化检出率在NILM、LSIL、HSIL及SCC组分别为45.2%、51.8%、81.2%和100.0%,4组间差异有统计学意义(P<0.05)。其中NILM和LSIL、LSIL和HSIL、HSIL和SCC组间差异无统计学意义(P均 >0.05);NILM和HSIL、NILM和SCC、LSIL和SCC组差异有统计学意义(P均<0.05,表2)。
进一步将FAM19A4、PAX1、miRNA124-2基因甲基化进行联合。
PAX1和miRNA124-2两指标联合检测结果显示,NILM和LSIL、HSIL和SCC组间差异无统计学意义(P均>0.05);NILM和HSIL、NILM和SCC、LSIL和HSIL、LSIL和SCC组差异有统计学意义(P均<0.05)。
PAX1和FAM19A4两指标联合检测结果显示,NILM和LSIL、LSIL和HSIL、HSIL和SCC组间差异无统计学意义(P均>0.05);NILM和HSIL、NILM和SCC、LSIL和SCC组差异有统计学意义(P均<0.05)。
miRNA124-2和FAM19A4两指标联合检测结果显示,NILM和LSIL、LSIL和HSIL、HSIL和SCC组间差异无统计学意义(P均>0.05);NILM和HSIL、NILM和SCC、LSIL和SCC组差异有统计学意义(P均<0.05)。
miRNA124-2、FAM19A4和PAX1指标联合检测结果显示,NILM和LSIL、NILM和LSIL、LSIL和HSIL、HSIL和SCC组间差异均无统计学意义(P均>0.05);NILM和HSIL、NILM和SCC、LSIL和SCC组间差异均有统计学意义(P均<0.05,表3)。
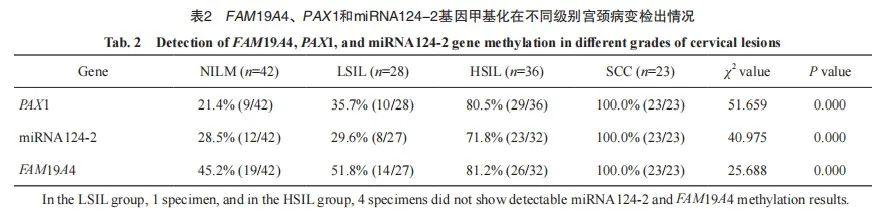
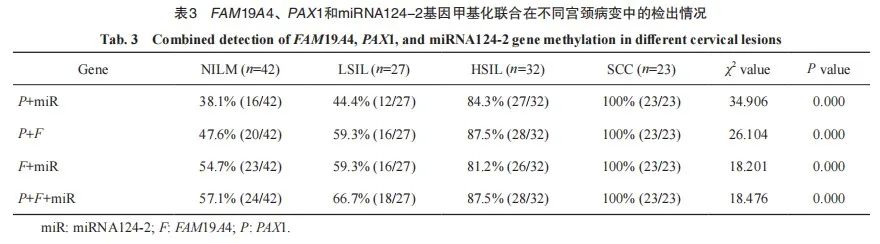
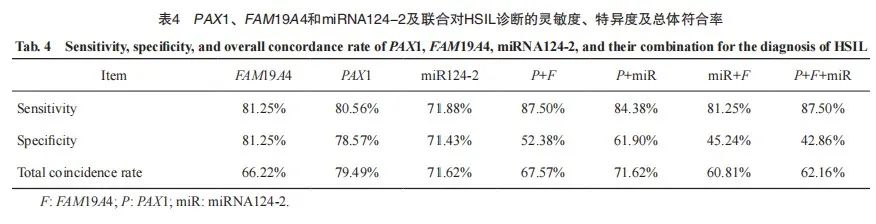
2.3 FAM19A4、PAX1及miRNA124-2甲基化诊断宫颈病变的灵敏度、特异度及总体符合率
以NILM为参照,FAM19A4、PAX1、miRNA124-2启动子甲基化诊断HSIL灵敏度分别为81.25%、80.56%和71.88%,特异度分别为54.76%、78.57%和71.43%,诊断总符合率分别为66.22%、79.49%和71.62%。
分别将PAX1和FAM19A4,PAX1和miR124-2,miR124-2和FAM19A4,PAX1、FAM19A4和miR124-2进行联合,诊断HSIL的灵敏度分别为87.50%、84.38%、81.25%和87.50%;特异度分别为52.38%、61.90%、45.24%和42.86%;诊断的总符合率分别为67.57%、71.62%、60.81%和62.16%(表4)。
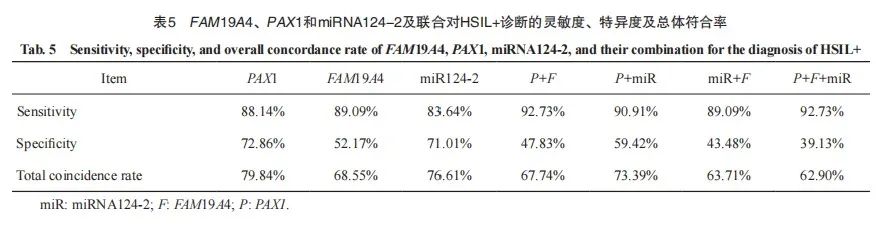
以NILM及LSIL为参照,PAX1、FAM19A4、miRNA124-2启动子甲基化诊断HSIL+(包括HSIL及SCC)灵敏度分别为88.14%、89.09%和83.64%,特异度分别为72.86%、52.17%和71.01%,诊断总符合率分别为79.84%、68.55%和76.61%。
分别将PAX1和FAM19A4,PAX1和miR124-2,miR124-2和FAM19A4,PAX1、FAM19A4和miR124-2进行联合,诊断HSIL+的灵敏度分别为92.73%、90.91%、89.09%和92.73%;特异度分别为47.83%、59.42%、43.48%和39.13%;诊断总符合率分别为67.74%、73.39%、63.71%和62.90%(表5)。
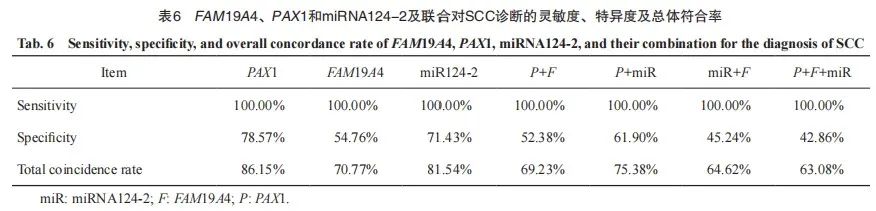
以NILM为参照,PAX1 、FAM19A4、miRNA124-2启动子甲基化诊断SCC的灵敏度均为100.00%;特异度分别为78.57%、54.76%和71.43%,诊断总符合率分别为86.15%、70.77%和81.54%。
分别将PAX1和FAM19A4,PAX1和miR124-2,miR124-2和FAM19A4,PAX1、FAM19A4和miR124-2进行联合,诊断SCC灵敏度均为100.00%;诊断的总符合率分别为69.23%、75.38%、64.62%和63.08%(表6)。
2.4 FAM19A4、PAX1、miRNA124-2甲基化及联合对SCC的诊断价值
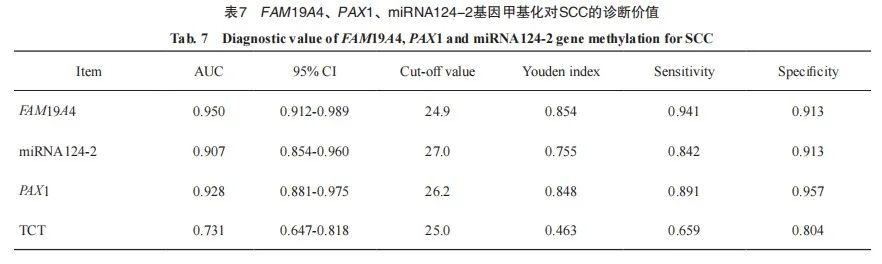
采用ROC曲线分别评价TCT、FAM19A4、PAX1及miRNA124-2基因甲基化对SCC的诊断效能。ROC曲线评价TCT对SCC的诊断结果显示,曲线下面积(area under curve,AUC)为0.731(95% CI:0.647~0.818),约登指数为0.463,诊断灵敏度和特异度分别为65.9%和80.4%;ROC曲线评价FAM19A4对SCC的诊断结果显示,AUC为0.950(95% CI:0.912~0.989),约登指数为0.854,诊断的灵敏度和特异度分别为94.1%和91.3%;ROC曲线评价miRNA124-2对SCC的诊断结果显示,AUC为0.907(95% CI:0.854~0.960),约登指数为0.755,诊断的灵敏度和特异度分别为84.2%和91.3%;ROC曲线评价PAX1对SCC的诊断结果显示,AUC为0.928(95% CI:0.881~0.975),约登指数为0.848,诊断的灵敏度和特异度分别为89.1%和95.7%(图1、表7)。
进一步将FAM19A4、PAX1及miRNA124-2基因甲基化指标进行联合,并采用ROC曲线评价其诊断SCC的效能。PAX1与FAM19A4联合对SCC的诊断ROC评价结果显示,AUC为0.950(95% CI:0.912~0.988),约登指数为0.854,诊断的灵敏度和特异度分别为94.1%和91.3%;PAX1与miRNA124-2联合对SCC的诊断ROC评价结果显示,AUC为0.929(95% CI:0.882 ~ 0.976),约登指数为0.848,诊断的灵敏度和特异度分别为95.7%和89.1%;FAM19A4与miRNA124-2联合对SCC的诊断ROC评价结果显示,AUC为0.951 (95% CI:0.913~0.989),约登指数为0.854,诊断的灵敏度和特异度分别为94.2%和91.2%;PAX1、FAM19A4及miRNA124-2联合对SCC的诊断ROC评价结果显示,AUC为0.952(95% CI:0.915~0.990),约登指数为0.851,诊断的灵敏度和特异度分别为100.0%和85.1%(图2、表8)。
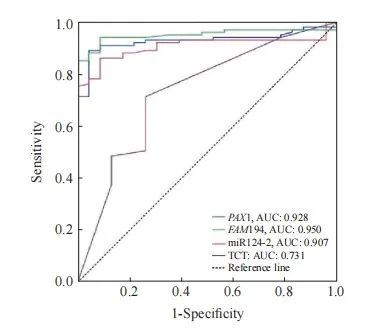
图1 FAM19A4、PAX1及miRNA124-2甲基化及TCT诊断SCC的ROC曲线
Fig. 1 ROC curves for the methylation of FAM19A4, PAX1 and miRNA124-2, and TCT diagnosis of SCC
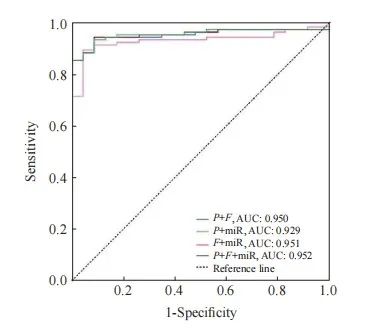
图2 FAM19A4、PAX1及miRNA124-2甲基化联合诊断SCC的ROC曲线
Fig. 2 ROC curve for the combined diagnosis of SCC using methylation of FAM19A4, PAX1, and miRNA124-2
P: PAX1; F: FAM19A4; miR: miRNA124-2.
2.5 FAM19A4、PAX1、miRNA124-2甲基化及联合对HSIL+的诊断价值
采用ROC曲线分别评价FAM19A4、PAX1及miRNA124-2基因甲基化对HSIL+的诊断效能。FAM19A4对HSIL+的诊断ROC评价结果显示,AUC为0.893(95% CI:0.870~0.959),约登指数为0.728,诊断的灵敏度和特异度分别为92.6%和80.2%;miRNA124-2对HSIL+的诊断ROC评价结果显示,AUC为0.889(95% CI:0.827~0.951),约登指数为0.713,诊断的灵敏度和特异度分别为91.3%和80.0%;PAX1对HSIL+ 的诊断ROC评价结果显示,AUC为0.925(95% CI:0.826~0.980),约登指数为0.801,诊断的灵敏度和特异度分别为92.8%和87.3%(图3、表 9)。
进一步将FAM19A4、PAX1及miRNA124-2基因甲基化指标进行联合并采用ROC曲线评价其诊断HSIL+的效能。PAX1与FAM19A4联合对HSIL+ 的诊断ROC评价结果显示,AUC为0.930(95% CI:0.879~0.981),约登指数为0.828,诊断的灵敏度和特异度分别为95.7%和87.1%;PAX1与miRNA124-2联合对HSIL+的诊断ROC评价结果显示,AUC为0.928(95% CI:0.875~0.981),约登指数为0.848,诊断的灵敏度和特异度分别为95.7%和89.1%;FAM19A4与miRNA124-2联合对HSIL+的诊断ROC评价结果显示,AUC为0.895(95% CI:0.832~0.959),约登指数为0.833,诊断的灵敏度和特异度分别为97.6%和85.7%;PAX1、FAM19A4及miRNA124-2联合对HSIL+ 的诊断ROC评价结果显示,AUC为0.928(95% CI:0.876~0.980),约登指数为0.818,诊断的灵敏度和特异度分别为100.0%和81.8%(表 10、图4)。
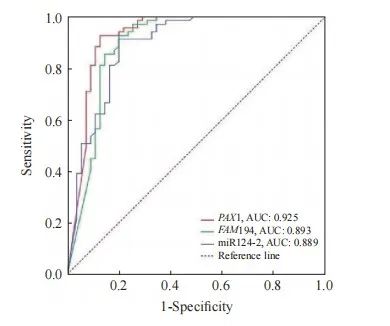
图3 FAM19A4、PAX1及miRNA124-2基因甲基化诊断HSIL+的ROC曲线
Fig. 3 ROC curve for the methylation of FAM19A4, PAX1 and miRNA124-2 in the diagnosis of HSIL+
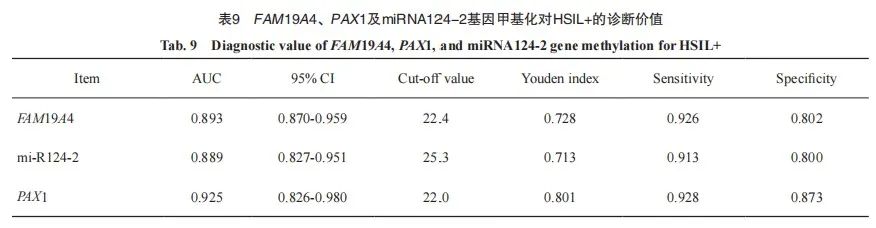
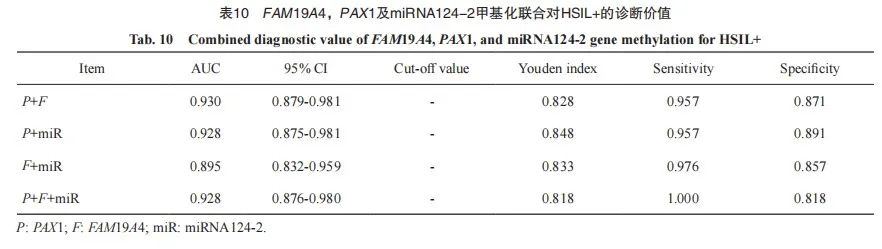
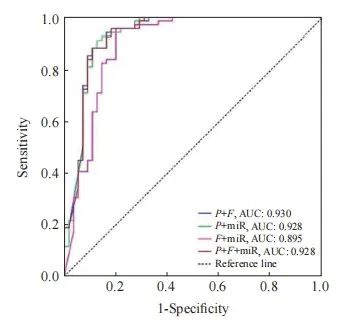
图4 FAM19A4、PAX1及miRNA124-2基因甲基化联合诊断HSIL+的ROC曲线
Fig. 4 ROC curve for the combined diagnosis of HSIL+ using methylation of FAM19A4, PAX1, and miRNA124-2
P: PAX1; F: FAM19A4; miR: miRNA124-2.
3 讨 论
尽管高危型HPV感染是宫颈病变发生的首要致病因素,但实际引发宫颈癌变的是多种表观遗传学改变的积累[14]。基因启动子区域CpG岛甲基化通常会导致基因表达沉默[15],且该事件发生在癌症病变早期[16],可见甲基化修饰是癌症诊治中潜在的、强大的诊断及预测预后的分子生物标志物。已有研究证明,异常的基因甲基化存在于早期的宫颈病变[17]。本研究结果证实,随宫颈病变级别的增高FAM19A4基因甲基化检出率呈显著增高趋势,在宫颈HSIL病变中普遍发生甲基化,阳性率达81.2%,而在SCC中甲基化率高达100.0%,且HSIL+患者的甲基化率显著高于NILM及LSIL患者。根据宫颈癌发生、发展的内在分子机制推测,FAM19A4基因启动子区发生甲基化很可能是宫颈病变发生过程中的重要分子事件,参与了宫颈癌发生的关键扳机点,很有潜力成为宫颈病变诊断的可靠指标。ROC曲线结果显示:FAM19A4诊断HSIL+时AUC为0.893,灵敏度为92.6%,特异度为80.2%;诊断SCC时AUC为0.950,灵敏度为94.1%,特异度为91.3%。可见,FAM19A4诊断SCC的灵敏度和特异度均较高。而传统TCT对SCC的诊断AUC仅为0.731,诊断的灵敏度和特异度仅为65.9%和80.4%。可见,应用FAM19A4启动子区甲基化诊断SCC具有更高的临床应用价值。
目前有关PAX1甲基化与宫颈病变相关性的报道还较少。但本研究发现随宫颈病变的加重,PAX1基因甲基化检出率呈明显增高趋势,HSIL患者PAX1甲基化阳性率为80.5%,SCC患者则高达100.0%。且HSIL+患者的甲基化检出率显著高于NILM及LSIL患者,这与Dvorská等[18]的研究结果相似。目前普遍认为宫颈HSIL以上病变才是真正的癌前病变,需要重点筛查、监测,而LSIL只是HPV感染引起的细胞形态学前驱改变,可见本研究结果与目前对宫颈病变的认识非常契合。PAX1甲基化很可能也参与了宫颈病变进程,将其作为预测宫颈病变发展趋势及HSIL+病变的诊断标志物同样具有较大潜力。ROC曲线进一步评价PAX1的诊断价值,结果显示:诊断HSIL+ 时AUC为0.925,灵敏度高达为92.8%,特异度为87.3%;PAX1诊断SCC时AUC为0.928,灵敏度为89.1%,特异度高达95.7%,其对宫颈病变的诊断价值同样优于细胞学检查。
miRNA124-2参与转录后基因表达调控,在机体许多生物学功能及过程中发挥作用[19],与口腔鳞状细胞癌、前列腺癌等疾病相关[20-21]。本研究发现miRNA124-2也参与宫颈病变的发生。随着宫颈病变级别的增加,miRNA124-2基因启动子区甲基化检出率也明显增高,HSIL患者的阳性率为71.8%,而SCC患者的阳性率高达100.0%,HSIL+患者的甲基化率显著高于NILM及LSIL患者,其甲基化改变趋势与FAM19A4、PAX1基因类似,但在HISL患者中的甲基化阳性率略低于FAM19A4和PAX1。由于miRNA124-2启动子区高甲基化可以抑制miRNA124-2的表达,因此在宫颈HSIL+患者中miRNA124-2负向调控细胞增殖、侵袭、分化及凋亡的能力就会被抑制,进而促进宫颈病变的进展,最终导致肿瘤的发生。由此可见,miRNA124-2的甲基化很可能促进了宫颈病变由LSIL到HSIL的转变及病变的进一步发展。ROC曲线结果显示,miRNA124-2诊断HSIL+的AUC为0.889,灵敏度为91.3%,特异度为80.0%;诊断SCC的AUC为0.907,灵敏度为84.2%,特异度为91.3%。可见,miRNA124-2基因启动子区甲基化对HSIL+病变诊断具有较高的敏感性,对SCC诊断具有较高的特异性。总之,miRNA124-2甲基化对HSIL+的诊断及预测宫颈病变的发展趋势具有较高的临床价值。
本研究结果表明,FAM19A4、PAX1及miRNA124-2基因启动子区甲基化阳性率随宫颈病变的加重而增高,且在HSIL+患者中3个基因启动子区普遍发生甲基化,而在SCC患者中全部发生甲基化,这充分表明三者甲基化改变与宫颈高度以上病变密切相关,这一研究结果与宫颈癌的内在发生、发展机制完全吻合。此外,3个基因甲基化在宫颈病变诊断及预测病变进展方面均具有较高的临床价值,比传统的细胞学检测,具有更高的灵敏度及特异度,这与Adcock等[22]的研究结论具有一致性。然而FAM19A4、PAX1及miRNA124-2并非宫颈病变的特异基因,为了进一步提高其诊断宫颈病变的敏感性和特异性,本研究将3个指标进行联合,结果显示,3个指标两两联合诊断SCC,AUC及诊断的灵敏度与单独应用均有所提高,其中miRNA124-2及PAX1联合诊断SCC的灵敏度最高达95.7%,PAX1及FAM19A4联合后诊断SCC的特异度高达91.3%。将3个指标同时联合应用诊断的灵敏度高达100.0%。由此可见,将3个甲基化指标进行联合可以提高其对宫颈病变诊断的敏感性和特异性。由于甲基化是肿瘤发生过程中的早期事件,通过检测3个基因启动子区的甲基化能在早期识别HSIL+,将其纳入宫颈癌筛查可在不降低HPV筛查灵敏度的基础上提高特异性,从而早期精准诊断宫颈病变。此外,3个基因甲基化检测可以更好的预测宫颈病变的发展趋势,真正早期识别高危个体,实现临床对患者进行分层管理,降低不必要的阴道镜转诊。总之,FAM19A4、PAX1及miRNA124-2甲基化检测用于预测宫颈病变进展及早期诊断非常具有优势。
但本研究是一个单中心、小范围、横断面研究,样本量小,在样本入选时可能存在一定的偏倚。本研究没有进一步追踪研究对象后续的病情发展,故FAM19A4、PAX1、miRNA124-2基因甲基化作为预测宫颈疾病进展的指标还需要进一步的深入研究。此外,本实验没有纳入较为少见的宫颈腺癌及非HPV相关的宫颈癌,故本文的结论并不适用于这些较为少见的宫颈癌类型。
综上所述,FAM19A4、PAX1及miRNA124-2基因启动子在宫颈HSIL+中发生显著甲基化,很可能参与了宫颈病变的发生、发展,对HSIL+尤其是SCC具有较高的诊断价值,有望成为预测宫颈病变进展及早期诊断的有效分子标志物。采用MSP检测基因甲基化具有性能稳定、方便可靠的优点,这为甲基化检测应用于临床奠定了技术基础。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
李雅:提出研究思路,研究方案可行性调查分析,确定研究对象范围,收集标本,负责具体的实验操作和数据收集,参与论文的起草和修订;刘慧:参与研究方案可行性调查分析,参与收集标本、试验及数据统计分析,参与论文的撰写和修订;任静静:参与研究设计,参与试验及数据统计与分析、论文的撰写和修订;李肖甫:为整个研究项目提供了理论和技术的指导和支持,参与论文的修订和审核;智艳芳:提出研究思路,设计研究方案,对研究设计、数据解读和论文写作等方面进行了全面的监督和指导。
[参考文献]
[1] TORRES-ROMAN J S, RONCEROS-CARDENAS L, VALCARCEL B, et al. Cervical cancer mortality among young women in Latin America and the Caribbean: trend analysis from 1997 to 2030[J]. BMC Public Health, 2022, 22(1): 113.
[2] BUSKWOFIE A, DAVID-WEST G, CLARE C A. A review of cervical cancer: incidence and disparities[J]. J Natl Med Assoc, 2020, 112(2): 229-232.
[3] LI B H, ZHANG L, ZHAO J G, et al. The value of cytokine levels in triage and risk prediction for women with persistent high-risk human papilloma virus infection of the cervix[J]. Infect Agent Cancer, 2019, 14: 16.
[4] EL ALIANI A, EL-ABID H, EL MALLALI Y, et al. Association between gene promoter methylation and cervical cancer development: global distribution and a meta-analysis[J]. Cancer Epidemiol Biomarkers Prev, 2021, 30(3): 450-459.
[5] LIANG L A, EINZMANN T, FRANZEN A, et al. Cervical cancer screening: comparison of conventional pap smear test, liquid-based cytology, and human papillomavirus testing as stand-alone or cotesting strategies[J]. Cancer Epidemiol Biomarkers Prev, 2021, 30(3): 474-484.
[6] JI W T, LOU W H, HONG Z B, et al. Genomic amplification of HPV, h-TERC and c-MYC in liquid-based cytological specimens for screening of cervical intraepithelial neoplasia and cancer[J]. Oncol Lett, 2019, 17(2): 2099-2106.
[7] VILLANUEVA L, ÁLVAREZ-ERRICO D, ESTELLER M. The contribution of epigenetics to cancer immunotherapy[J]. Trends Immunol, 2020, 41(8): 676-691.
[8] HAINES K, XU F, VAN ARSDALE A, et al. Investigation of perturbation of DNMT and TET enzymes in endometrial cancer (308)[J]. Gynecol Oncol, 2022, 166: S161-S162.
[9] KELLY H, BENAVENTE Y, PAVON M A, et al. Performance of DNA methylation assays for detection of high-grade cervical intraepithelial neoplasia (CIN2+): a systematic review and meta-analysis[J]. Br J Cancer, 2019, 121(11): 954-965.
[10] FANG C, WANG S Y, LIOU Y L, et al. The promising role of PAX1 (aliases: HUP48, OFC2) gene methylation in cancer screening[J]. Mol Genet Genomic Med, 2019, 7(3): e506.
[11] CHENG S J, CHANG C F, KO H H, et al. Hypermethylated ZNF582 and PAX1 genes in oral scrapings collected from cancer-adjacent normal oral mucosal sites are associated with aggressive progression and poor prognosis of oral cancer[J]. Oral Oncol, 2017, 75: 169-177.
[12] SMOLARZ B, DURCZYŃSKI A, ROMANOWICZ H, et al. The role of microRNA in pancreatic cancer[J]. Biomedicines, 2021, 9(10): 1322.
[13] The clinical application value of FAM19A4/mir124-2 methy lation test in hrHPV-positive women[J]. Cancer Cell Res, 2022, 9(33).
[14] KUMAR R, PAUL A M, RAMESHWAR P, et al. Epigenetic dysregulation at the crossroad of women’s cancer[J]. Cancers, 2019, 11(8): 1193.
[15] XU W X, XU M Y, WANG L L, et al. Integrative analysis of DNA methylation and gene expression identified cervical cancer-specific diagnostic biomarkers[J]. Signal Transduct Target Ther, 2019, 4: 55.
[16] GUO M Z, PENG Y J, GAO A A, et al. Epigenetic heterogeneity in cancer[J]. Biomark Res, 2019, 7: 23.
[17] LI N, HU Y J, ZHANG X Y, et al. DNA methylation markers as triage test for the early identification of cervical lesions in a Chinese population[J]. Int J Cancer, 2021, 148(7): 1768-1777.
[18] DVORSKÁ D, BRANÝ D, NAGY B, et al. Aberrant methylation status of tumour suppressor genes in ovarian cancer tissue and paired plasma samples[J]. Int J Mol Sci, 2019, 20(17): 4119.
[19] 周俏苗, 汪洪林, 黄海燕, 等. MiR-124-3p靶向调控MAPK 14对子痫前期大鼠胎盘滋养层细胞增殖及侵袭的影响[J]. 中国比较医学杂志, 2020, 30(6): 1-9.
ZHOU Q M, WANG H L, HUANG H Y, et al. MiR-124-3p affects proliferation and migration in preeclampsia pathogenesis by targeting MAPK 14[J]. Chin J Comp Med, 2020, 30(6): 1-9.
[20] JIA X Q, WANG X, GUO X R, et al. MicroRNA-124: an emerging therapeutic target in cancer[J]. Cancer Med, 2019, 8(12): 5638-5650.
[21] SHIMIZU T, SUZUKI H, NOJIMA M, et al. Methylation of a panel of microRNA genes is a novel biomarker for detection of bladder cancer[J]. Eur Urol, 2013, 63(6): 1091-1100.
[22] ADCOCK R, NEDJAI B, LORINCZ A T, et al. DNA methylation testing with S5 for triage of high-risk HPV positive women[J]. Int J Cancer, 2022, 151(7): 993-1004.


