苏州大学刘庄/朱文俊AFM:改性壳聚糖用于高效非侵入性经皮传递过氧化氢酶修复和预防皮肤光损伤
时间:2024-07-29 14:02:33 热度:37.1℃ 作者:网络
氧化应激由过量的活性氧(ROS)引起,在众多皮肤疾病的发生和发展中扮演着重要角色,这就需要有效的抗氧化防御来预防和修复氧化损伤。然而,现有的皮肤疾病系统性抗氧化治疗在高效传递抗氧化剂到病变部位方面常常不足。在本研究中,苏州大学功能纳米与软物质研究院刘庄/朱文俊设计了一种新型的非侵入性经皮传递平台,利用接枝了水杨酸胆碱钠(SCS)的壳聚糖,用于高效传递生物分子酶,如过氧化氢酶(CAT)。与过氧化氢酶自组装后得到的SCS-CAT纳米复合体,如果通过局部应用在乳膏中,表现出高效的皮肤穿透和累积能力。由于CAT能有效清除ROS,局部应用的SCS-CAT纳米复合体能显著修复和保护由紫外线B(UVB)引起的皮肤光损伤,通过抑制细胞凋亡和炎症来实现。此外,由于其良好的生物相容性,这种SCS-CAT传递平台有望用于长期皮肤护理应用。本研究提出了一个简单而具有变革性的平台,用于生物酶的皮内传递,为治疗各种炎症性皮肤疾病提供了一个有希望的途径。该研究以题为“Modified Chitosan for Highly Efficient Non-Invasive Transdermal Delivery of Catalase to Repair and Prevent Skin Photodamages”的论文发表在《Advanced Functional Materials》上。

图1展示了SCS作为非侵入性经皮传递平台的示意图,用于有效治疗由氧化应激引起的皮肤疾病。该图说明了利用接枝了水杨酸胆碱钠的壳聚糖(SCS)与过氧化氢酶(CAT)自组装形成的SCS-CAT纳米复合体,通过局部应用在乳膏中,能够有效穿透皮肤并在皮肤内积累。由于CAT能有效清除过量的活性氧(ROS),SCS-CAT纳米复合体能显著修复和保护皮肤免受紫外线B(UVB)引起的光损伤,通过抑制细胞凋亡和炎症反应实现这一效果。此外,由于SCS-CAT平台具有很好的生物相容性,它也显示出在长期皮肤护理应用中的潜力。
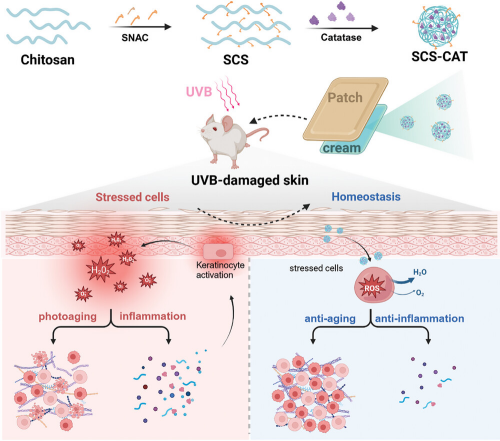
图1. SCS作为非侵入性经皮传递平台的示意图,用于抗氧化治疗有效治疗由氧化应激引起的皮肤疾病
【SCS-CAT纳米复合体的制备和表征】
图2通过动态激光散射(DLS)技术,研究者们确定了SCS和CAT以2:1的质量比混合时形成的纳米复合体具有最小的流体动力学尺寸约310纳米,并且显示出24小时内良好的稳定性。透射电子显微镜(TEM)图像揭示了这些纳米复合体在干燥状态下呈现均匀的纳米球形态,直径约200纳米。此外,圆二色光谱分析显示SCS-CAT纳米复合体中CAT的二级结构与自由CAT高度相似,表明其结构完整性得到了保持。通过测量酶催化活性,发现SCS-CAT纳米复合体显示出与自由催化酶相似的活性。这些结果表明,SCS-CAT纳米复合体成功制备,具有良好的物理稳定性和生物活性,为进一步的皮肤穿透和抗氧化治疗提供了坚实的基础。
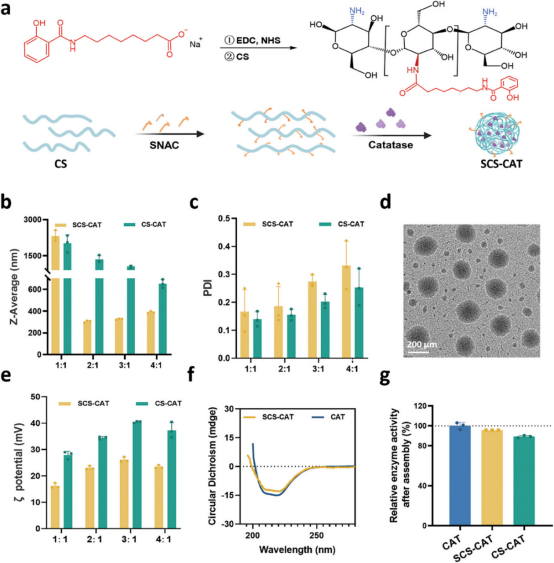
图2. SCS-CAT纳米复合体的制备和表征
【SCS-CAT纳米复合体的经皮机制】
图3阐释了SCS-CAT纳米复合体的经皮传递机制。研究者们利用Franz扩散池系统评估了SCS-CAT对大生物分子如蛋白质的非侵入性经皮传递能力。实验结果显示,SCS-CAT在小鼠皮肤上的应用显著提高了皮肤保留率至12%,是未使用SCS组的4倍。此外,SCS-CAT的皮肤穿透率相对较低,这可能归因于SCS增加的亲水性导致与皮肤层强烈相互作用。共聚焦显微镜成像揭示了SCS-CAT组在皮肤不同层中有强烈的荧光信号,表明SCS显著提高了蛋白质的皮内传递。研究还初步探讨了SCS-CAT纳米复合体的经皮传递机制,包括通过细胞间隙、跨细胞途径和毛囊附属途径。体外实验表明,SCS-CAT能可逆地扩大细胞间隙,通过改变细胞骨架结构促进物质的经皮传递。此外,SCS-CAT还通过依赖于高尔基体和小管的跨细胞途径增加了跨细胞运输。体内外实验结果表明,SCS-CAT纳米复合体通过多种途径有效穿透皮肤,为生物大分子的非侵入性经皮传递提供了一种有效的策略。
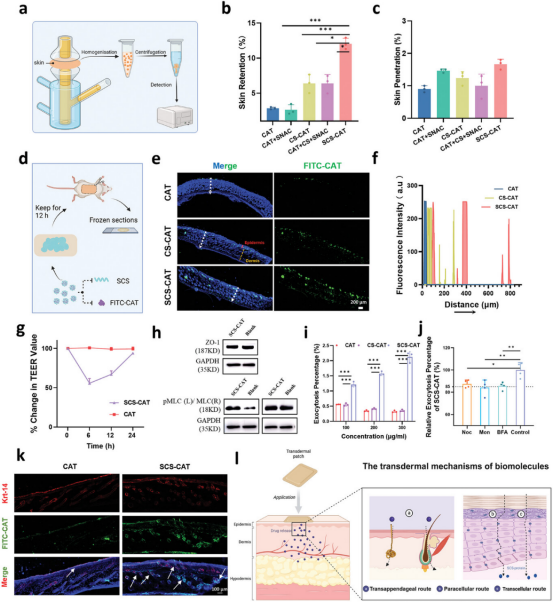
图3. SCS-CAT纳米复合体的经皮机制
【SCS-CAT修复体外光损伤HACAT细胞】
图4通过建立UVB诱导的光损伤细胞模型,研究者们评估了自由CAT和SCS-CAT纳米复合体对恢复细胞活性和促进细胞增殖的能力。MTT细胞活性实验和划痕实验表明,SCS-CAT处理能够在24小时和36小时时间点显著提高HACAT细胞的迁移速度,接近未受UVB辐射的正常细胞水平。此外,SCS-CAT相比于自由CAT显示出更优越的细胞内ROS清除能力和抗凋亡效果,这可能是由于SCS-CAT的增强细胞摄取能力,有利于清除细胞内ROS,恢复细胞的氧化还原平衡。流式细胞术分析进一步证实了SCS-CAT在减少UVB诱导的细胞凋亡方面的高效性。总体而言,SCS-CAT纳米复合体通过提高细胞活性、促进细胞增殖和迁移,以及有效清除ROS和抑制凋亡,展现了对光损伤皮肤细胞的显著修复能力。
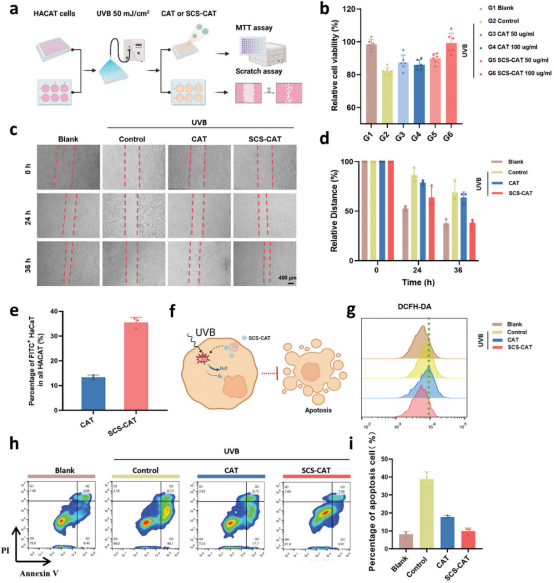
图4.SCS-CAT修复体外光损伤HACAT细胞
【局部应用SCS-CAT修复光损伤皮肤】
图5通过在Balb/C小鼠上建立UVB诱导的皮肤光损伤模型,并使用不同处理的乳膏进行治疗,研究发现SCS-CAT组在治疗5天后显示出显著改善的皮肤状况,如减轻红斑和皮肤病变。组织学分析,包括苏木精-伊红(H&E)染色和Masson三色(MTC)染色,显示SCS-CAT处理显著减少了UVB损伤皮肤的表皮厚度和组织学不规则性,表明其在减轻炎症症状方面的显著效果。此外,SCS-CAT还有效抵抗了由UVB引起的光老化,通过维持皮肤中胶原蛋白的沉积和排列,类似于健康皮肤。免疫荧光染色和酶联免疫吸附试验(ELISA)进一步证实了SCS-CAT在减少皮肤中ROS积累、抑制细胞凋亡和调节胶原合成方面的作用,从而维持皮肤的健康状态。
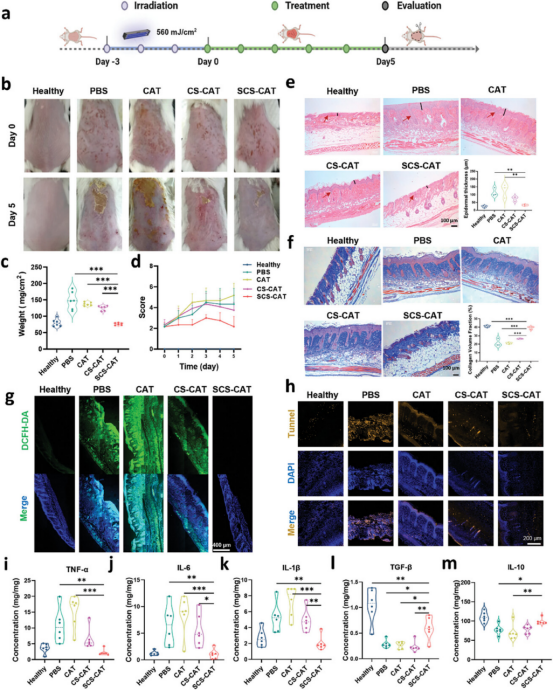
图5. 局部应用SCS-CAT修复光损伤皮肤
【局部应用SCS-CAT纳米复合体保护皮肤免受光损伤】
图6探讨了SCS-CAT纳米复合体在光保护方面的应用,通过在小鼠皮肤上进行UVB辐射处理并随后进行局部处理,研究了其对UVB损伤的保护效果。实验结果显示,与仅用PBS处理的对照组相比,SCS-CAT处理显著减轻了皮肤红斑、充血和弹性减少等UVB引起的损伤症状。此外,通过苏木精-伊红(H&E)染色和Masson三色(MTC)染色观察到,SCS-CAT有效防止了表皮层厚度增加和胶原纤维降解,从而抵抗了日晒性皮炎和光老化的进展。免疫荧光染色揭示了SCS-CAT在维持皮肤内ROS水平和抗氧化平衡方面的作用,减少了氧化应激,进而稳定了皮肤炎症介质如TNF-α、IL-6和IL-1β的水平,并防止了IL-10的下调,从而降低了日晒型皮炎的发生率。同时,SCS-CAT还通过减少细胞凋亡和调节TGF-β,保护了皮肤中的胶原蛋白,延缓了皮肤光老化的进程。
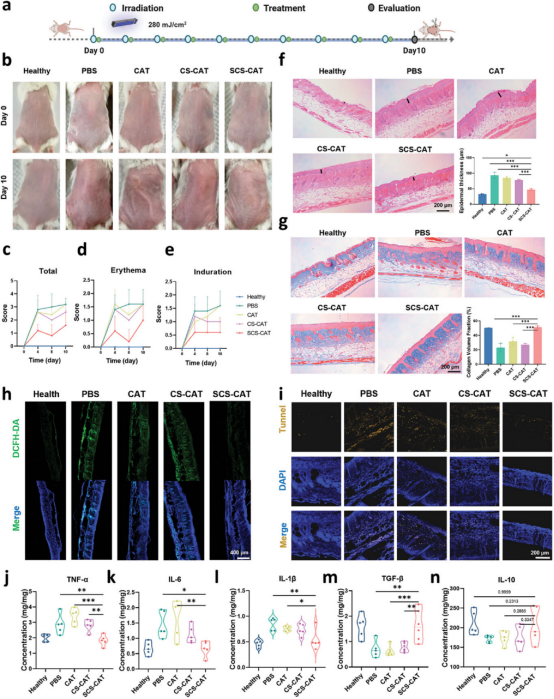
图6. 局部应用SCS-CAT纳米复合体保护皮肤免受光损伤
【SCS-CAT经皮传递系统的安全性评估】
图7进行了SCS-CAT经皮传递系统的安全性评估。通过在裸鼠模型上连续14天局部应用含有SCS-CAT的乳膏,研究者监测了小鼠的体重变化和皮肤状况。结果显示,小鼠体重在整个治疗期间保持稳定,且在给药部位的皮肤没有出现腐蚀或炎症的迹象,表明SCS-CAT乳膏温和且无刺激性。进一步的组织学检查显示,主要器官(心脏、肝脏、脾脏、肺、肾脏和皮肤)没有发生器官变化,证实了SCS-CAT经皮传递系统具有良好的生物相容性。这些结果表明,SCS-CAT经皮传递系统在长期应用中是安全的,具有发展成为抗氧化护肤产品的潜力。
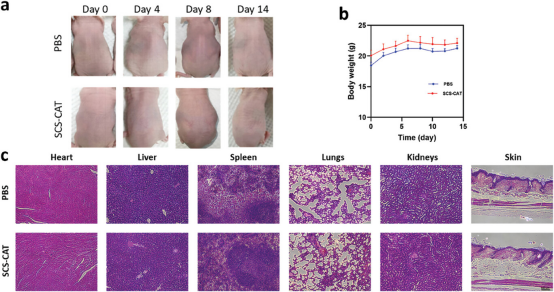
图7. SCS-CAT经皮传递系统的安全性评估
【小结】
该研究提出了一种新型的非侵入性经皮传递平台,该平台利用接枝了水杨酸胆碱钠的壳聚糖(SCS),高效地传递抗氧化酶,例如过氧化氢酶(CAT)。通过自组装形成均匀的纳米复合体,这些纳米颗粒能够通过多种途径,包括细胞间隙、跨细胞和毛囊附属途径,有效增强皮肤穿透和保留。局部应用的SCS-CAT纳米复合体通过强大的ROS清除和抗炎效果,加速了光损伤皮肤的修复并预防了进一步损伤。总体而言,这项工作展示了一种具有高ROS底物特异性和高效ROS清除效率的新型抗氧化治疗策略,对治疗各种由氧化应激引起的皮肤疾病具有重要的临床应用前景。同时,开发的SCS作为经皮穿透载体,对于非侵入性地传递治疗性生物大分子,包括分子量达数百千道尔顿的分子,显示出潜在的应用前景,这可能彻底改变皮肤自身免疫性疾病等通常用局部小分子激素药物或系统性抗体治疗的疾病的管理方式。
原文链接:
https://doi.org/10.1002/adfm.202409416


