Adv Sci:北京大学刘欣宇/邓旭亮制备了新型纳米放射增敏剂用于原位口腔癌治疗
时间:2024-07-11 13:00:56 热度:37.1℃ 作者:网络
放射治疗在癌症治疗中起着至关重要的作用。然而,肿瘤的缺氧微环境极大地限制了疗效,因此开发一种简单、高效、安全的放射增敏剂来逆转缺氧并提高放疗效果至关重要。
2024年7月7日,北京大学刘欣宇及邓旭亮共同通讯在Advanced Science 在线发表题为““Abraxane-Like” Radiosensitizer for In Situ Oral Cancer Therapy”的研究论文,研究中受经典纳米药物Abraxane结构的启发,通过生物矿化诱导自组装制备了一种天然HSA修饰的CaO2纳米颗粒体系(CaO2-HSA)。
CaO2-HSA会在肿瘤组织中积聚并分解产生氧气,从而改变肿瘤内的缺氧状况。同时,ROS和钙离子会导致钙超载,进一步引发免疫原性细胞死亡。值得注意的是,其致敏比(SER=3.47)远高于临床上使用的甘氨双唑钠。此外,在原位口腔癌的动物模型中,CaO2-HSA能有效抑制肿瘤生长。凭借其高效、简单的制备和无重金属的生物安全性等优点,CaO2-HSA的放射增敏剂在口腔癌治疗方面具有巨大潜力。

口腔鳞状细胞癌(OSCC)是口腔最常见的恶性肿瘤,严重影响患者的发声、呼吸、咀嚼、吞咽等重要生理功能,其5年生存率低(<60%)甚至威胁患者的生命。目前,手术和放疗仍然是标准的治疗选择。与手术治疗存在术后损害的风险相比,放疗因其无创性和良好的耐受性,在治疗OSCC方面具有更大的潜力。然而,大型实体瘤的缺氧微环境会减轻电离辐射对肿瘤细胞DNA的损伤作用,导致放疗效果不理想。Gray等人报道,杀死缺氧细胞所需的辐射暴露是正常细胞的三倍,简单地增加辐射剂量会导致不良的副作用。因此,重塑缺氧微环境已成为改善放疗疗效的一种有前景的策略。
目前被用于临床的放射增敏剂可以模拟氧气,以防止放疗后的DNA修复,其目的是增加肿瘤对电离辐射的敏感性,促进肿瘤的失活。例如,如硝唑等电子亲和化合物和甘氨双唑钠,已分别在丹麦和中国用于治疗颈部和头部癌症。然而,作为化学小分子,这些基于硝基咪唑衍生物的放射增敏剂存在潜在的神经毒性、清除速度快导致生物利用度差、靶向功能有限导致肿瘤蓄积低等问题。
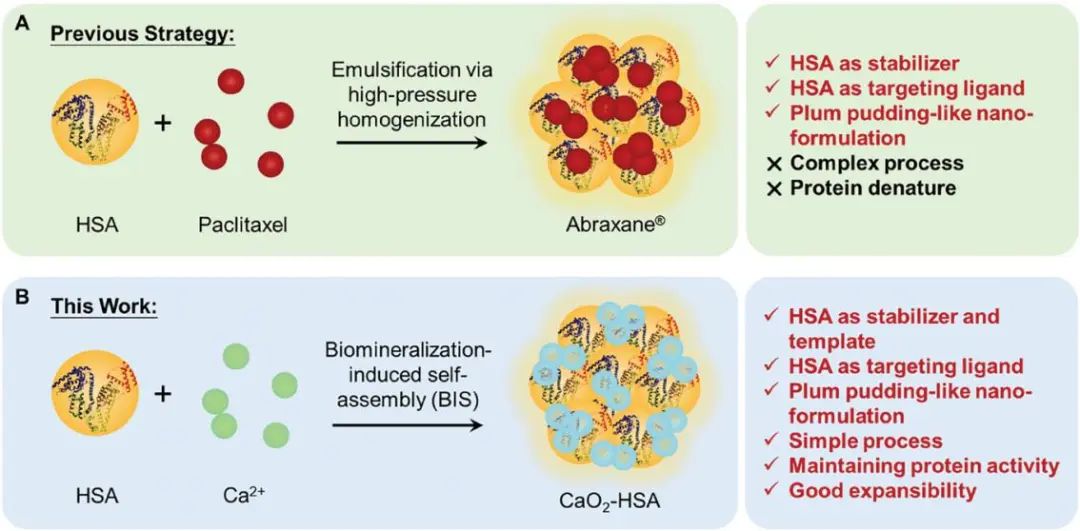
Abraxane与CaO2-HSA在制备方法和性能上的异同(图源自Advanced Science )
纳米医学的进步为开发新型放射增敏剂提供了机会。过氧化钙(CaO2)作为一种常见的无毒供氧剂,不仅在水产养殖和污水处理中得到了广泛的应用,而且在肿瘤治疗中也得到了广泛的应用,尤其是纳米级的CaO2。近年来,由于氧化钙纳米颗粒能够产生有毒的活性氧(ROS),它已被用于化学动力治疗(CDT),以及光热治疗(PTT)和光动力治疗(PDT)等各种联合治疗。此外,还发现钙超载会增加肿瘤钙化,进而介导细胞死亡。然而,由于其稳定性差,靶向能力有限,CaO2纳米颗粒对原位口腔癌的放疗增敏潜力尚未得到很好的研究。
Abraxane是一种经典的白蛋白结合紫杉醇纳米药物,是美国食品和药物管理局批准的第一个含白蛋白的化疗药物。它也是近年来最畅销的纳米药物。采用高压均质法制备Abraxane,得到尺寸约为130 nm的纳米颗粒,白蛋白和紫杉醇均匀分布在整个纳米颗粒中。这种结构不仅提高了制剂的稳定性,而且通过内源性天然白蛋白途径改善了药物向肿瘤的传递。受典型纳米药物Abraxane结构的启发,作为概念证明,本文描述了一种人血清白蛋白(HSA)修饰的CaO2纳米颗粒(CaO2-HSA)体系(方案1),并探索其作为原位口腔癌放射增敏剂的应用。具体而言,HSA具有与钙离子的结合能力,是纳米颗粒的优良稳定剂,通过生物矿化过程,作为生物模板,合成了均匀稳定的CAO2 -HSA共组装纳米颗粒。它还具有改善药代动力学的独特能力,已成为增强肿瘤组织靶向性的有希望的候选分子。随后,验证了CAO2 -HSA的抗肿瘤活性来源于钙超载诱导的细胞死亡和放射致敏作用,并通过转录组测序进一步验证了这一点。此外,利用小动物辐射研究平台构建原位OSCC动物模型,评估CAO2 -HSA致敏系统的生物安全性和有效性,发现CAO2 -HSA可显著提高致敏增强比(SER),并在体内表现出更好的最终治疗效果。
参考信息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202309569


