“绘”解读真报告丨肺癌检出BRAF 12号外显子的非V600变异,如何解读?
时间:2024-07-09 12:00:35 热度:37.1℃ 作者:网络
BRAF基因是肺癌备受关注的驱动基因变异,突变的患者整体生存较差,是提示预后不良的标志物。BRAF在我国NSCLC中的突变率为3.2%(腺癌3.4%;鳞癌2.1%),其中以BRAF V600突变最为常见,而BRAF非V600突变则呈现出更强的分子异质性,据统计,存在超过40种BRAF非V600变异[1]。
既往,我司多个产品为不同肺癌患者检出BRAF非V600突变。举近期的例子,如,患者1:54岁男性,病理诊断为(右肺上叶)腺癌,检测标本为石蜡切片。送检肺癌76基因项目,检出BRAF p.Asn486_Pro490del,即p.N486_P490del突变,该突变位于BRAF基因12号外显子,属于框内整码缺失突变,变异丰度(VAF)为18.11%。
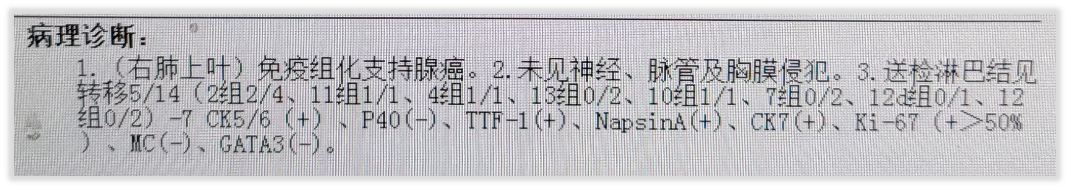
图1 患者1病理报告
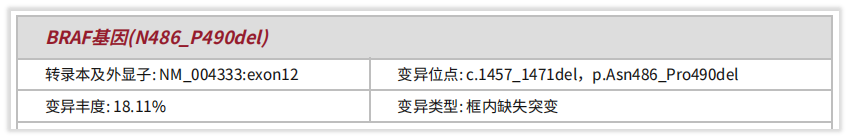
图2 患者1报告检出BRAFp.Asn486_Pro490del突变
患者2:63岁男性,病理诊断为肺腺癌,检测标本为石蜡切片。送检肺癌18基因项目,检出BRAF p.V487_P492delinsA,即p.Val487_Pro492delinsAla突变,该突变位于BRAF基因12号外显子,属于框内整码缺失插入突变,VAF为2.11%。

图3 患者2报告检出BRAF p.V487_P492delinsA突变
多位患者均从我司成熟的检测分析及专业的报告解读中,获得了后续的临床治疗指导。在此,我们以患者1的检出为案例代表,对BRAF p.Asn486_Pro490del突变,乃至BRAF非V600突变进行较为全面的解读,以期更多地获益于更广泛的肿瘤患者。
一、患者检出的BRAF突变属于哪一种亚型?
据《中国晚期非小细胞肺癌BRAF突变诊疗专家共识》介绍[2],BRAF突变在NSCLC患者中的发生率约为1.5%—5.5%,其中,BRAF V600突变约占30%—50%,相对常见,整体预后较差。
共识结合突变位点和功能,将BRAF基因突变进一步细分为三类:I类为非RAS依赖型单体,具有高BRAF激酶活性,具有高BRAF激酶活性,涉及密码子600(如V600E, V600K, V600D等);II类为非RAS依赖型二聚体,具有中等或高BRAF激酶活性,涉及600以外的密码子(如K601E、L597V/Q/R、G469V/S/R/E/A、G464V);III类为RAS依赖型二聚体,激酶活性受损,放大ERK通路、增加RAS活性(如G596R,D594Y/N/G/E, N581Y/S/I, G466V/L/E/A, D287Y)。
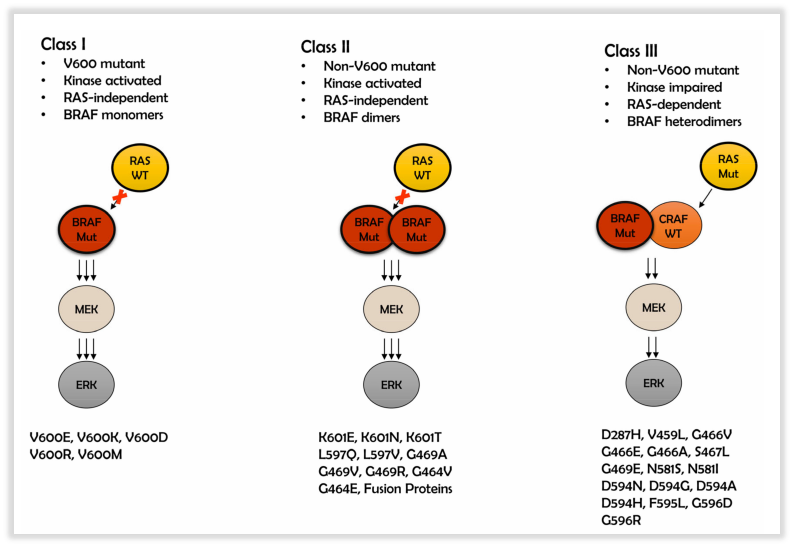
图4 BRAF基因突变的位点分类及其信号传导途径
根据回顾性研究结果,相比于BRAF I类突变患者,II类和III类突变患者更容易发生脑转移(9% vs 29% vs 31%),在一项对236例诊断为NSCLC BRAF突变患者的回顾性分析中,29%的患者在初诊时会合并脑转移(n=69),II类突变和III类突变的脑转移率显著升高(p=0.011,I类vs II类;p=0.007,I类vs III类),另一项研究纳入的3例非V600突变的病例报告中有2例发生脑转移[3]。
针对本案例患者检出的BRAF p.N486_P490del突变,有研究表明,该突变导致BRAF蛋白激酶活性增加,中-强活化激酶活性,归类为BRAF基因II类突变。在2018年的一篇研究中报道[4],类似于p.N486_P490del的缺失插入变异总体仅占BRAF基因突变的2%(23/1061),并且超过90%的患者都是腺癌亚型,23例患者中有3例N486_P490del突变(约千分之三)。
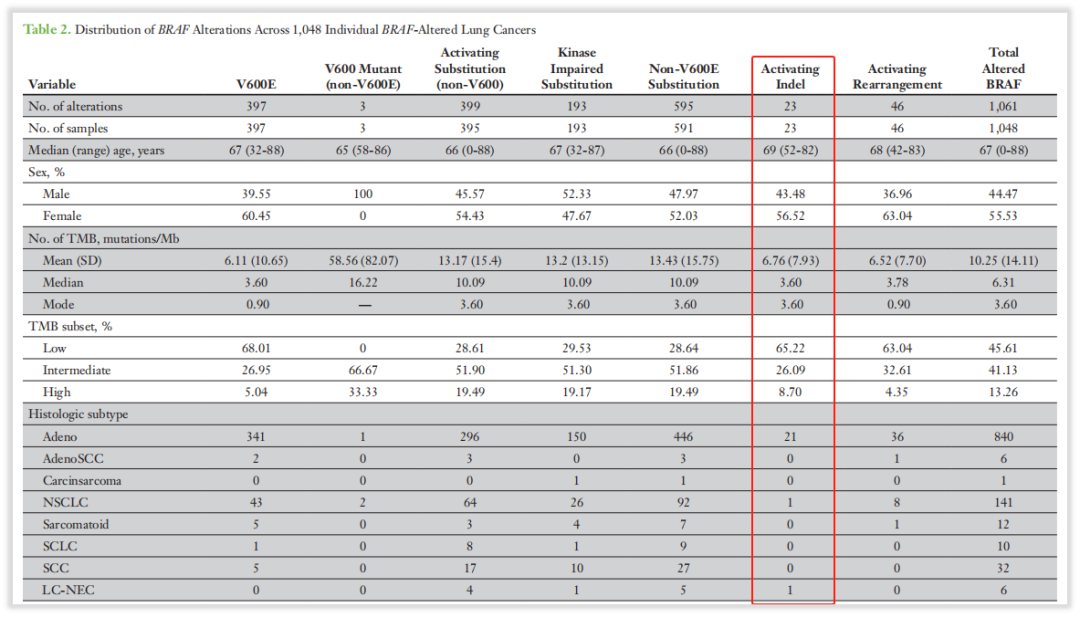
图5 BRAF突变各亚型在肺癌中的分布
二、患者BRAF突变可以考虑达拉非尼+曲美替尼治疗吗?
目前,针对BRAF V600突变阳性的转移性NSCLC,“达拉非尼联合曲美替尼”已经获批,是国内外指南优先推荐的方案之一,且纳入新版国家医保。此外,恩考芬尼联合比美替尼也于去年获批[5]。而针对BRAF II类和III类突变尚缺乏标准治疗方案,一系列临床研究和个案报道几乎都是围绕I类突变的靶向药物开展(详情可关注:BRAF V600E和非V600突变非小细胞肺癌患者靶向治疗现状)。
患者本次检出罕见的II类BRAF突变目前是有案例报道[6],提供了达拉非尼联合曲美替尼的后线治疗的可行性。
患者为79岁女性,在确诊IV期NSCLC后检出BRAF p.N486_P490del突变、PD-L1肿瘤比例评分(TPS)为90%,随后序贯接受帕博利珠单抗、卡铂+培美曲塞、多西他赛等多种治疗方案,出现恶性腹水发生转移。NGS再次检出BRAF p.N486_P490del突变,结合BRAF突变的功能以及多篇跨癌种用药的案例,尝试达拉非尼联合曲美替尼方案,治疗3个月后影像学显示肺部病灶缩小、数量减少,且腹水减少,后续治疗6个月和9个月的影像学均显示持续缓解,且不良反应可控(详情可关注:首例:携带罕见BRAF p.N486_N490del突变的非小细胞肺癌获益达拉非尼联合曲美替尼)。
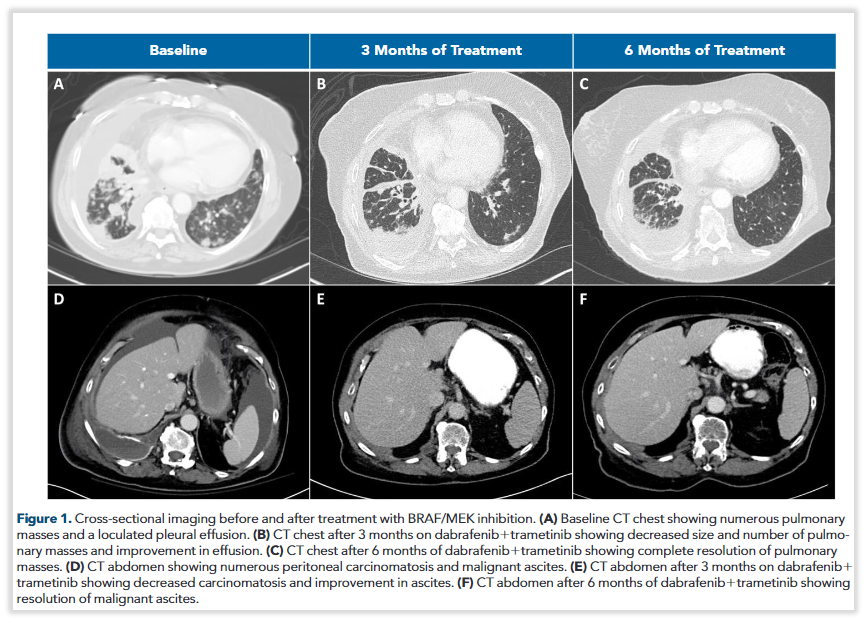
图6 使用达拉非尼联合曲美替尼治疗前后的CT影像
(A) 基线CT:肺部多肿块和胸腔积液。(B) 治疗3个月后。(C) 治疗6个月后。(D) 基线CT:腹部多肿块和腹腔积液。(E) 治疗3个月后。(F) 治疗6个月后
另外,文献给出了BRAF p.N486_P490del在其他肿瘤中发生和治疗的案例。在三例胰腺癌患者的后线治疗中,均达到了部分缓解,其中一例患者使用达拉非尼治疗(部分缓解[PR] 4个月),一例患者使用曲美替尼(PR 5.5个月),一例患者使用达拉非尼+曲美替尼(PR 6个月);在两例朗格汉斯细胞组织增多症患者的后线治疗中,使用曲美替尼治疗,一例达到完全缓解(CR)18个月,一例PR 12个月。再次证实BRAF p.N486_P490del突变的其他肿瘤依然可以从常规达拉非尼、曲美替尼等BRAF抑制剂中获益。
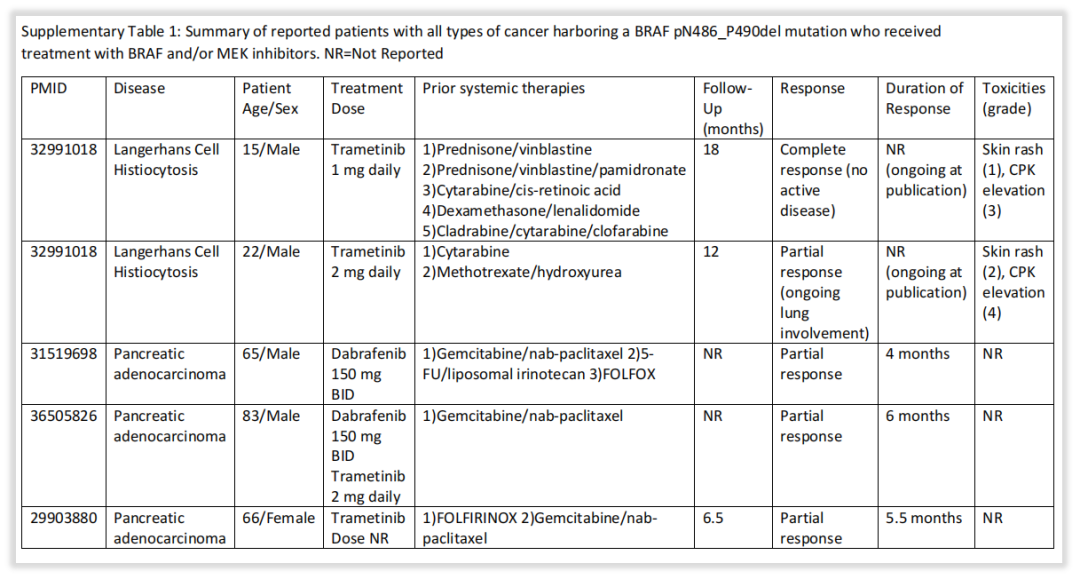
图7 BRAF p.N486_P490del在其他肿瘤中的突变以及相应治疗案例
三、回归共识,BRAF非V600突变的肺癌有哪些关注点?
研究显示,不同BRAF突变类型的组织病理学特征存在差异。一项中国BRAF突变 NSCLC患者临床病理特征的研究显示[7],与非BRAF突变患者(948 例)相比,BRAF突变患者(28例,其中V600E突变24例)中以肺腺癌(分别为 89.3% 和 70.6%;P=0.048)和女性、轻度或无吸烟史的患者(分别为78.6%和56.7%;P=0.019)更为常见。然而,像患者检出的BRAF非V600突变型则多出现在重度吸烟者中。共识推荐意见[2]:所有经病理学诊断为肺浸润性腺癌(包括含腺癌成分)的患者均应进行BRAF基因突变检测。对于晚期NSCLC患者,BRAF基因检测能够有效筛选BRAF抑制剂获益人群。建议优先选用组织标本进行BRAF基因突变检测,若组织标本获取困难,可考虑使用液体活检补充检测。
化疗和免疫治疗对于BRAF非V600突变NSCLC患者的临床研究目前还处于探索阶段,化疗和免疫治疗对于该类人群治疗数据多参考驱动基因阴性的研究结果。在免疫治疗上,多项大队列研究显示在NSCLC中,相较于BRAFV600E突变患者,BRAF非V600E突变的患者高肿瘤突变负荷(TMB-H)的比例更高(中位值分别为3.5和9.6mut/Mb,n分别为118和208)。BRAF非V600突变与肿瘤免疫原性高和炎症性微环境相关,提示接受免疫治疗获益的可能性更大[8]。
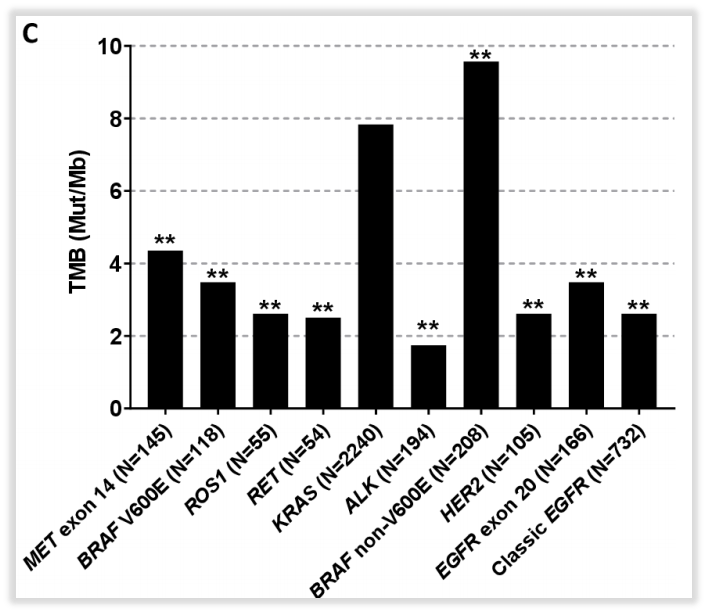
图8 相较BRAFV600E突变,非V600E突变的患者TMB-H的比例更高
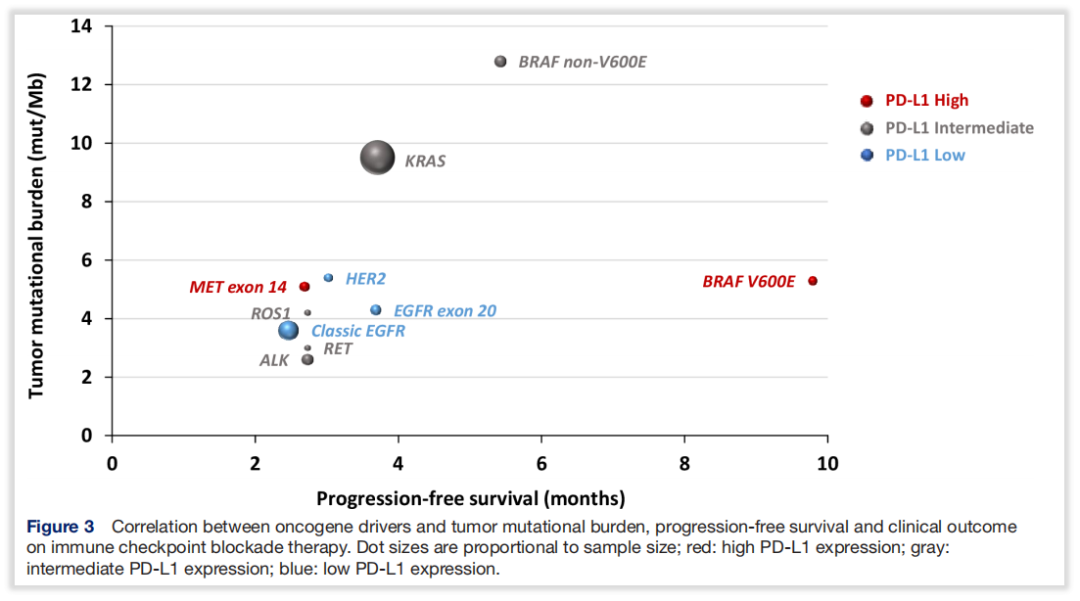
图9 非V600E突变的患者TMB-H与ICI治疗的关系
结合BRAF V600突变和非V600突变患者在靶向药物的证据等级差异,以及获益于免疫治疗的可能性原因。《驱动基因阳性晚期非小细胞肺癌免疫治疗专家共识(2023版)》共识意见7提出,对于BRAF非V600突变患者,推荐一线使用以ICIs为基础的治疗策略;对于BRAF V600突变患者,推荐在靶向治疗不可及或耐药后发生广泛进展时考虑使用以ICIs为基础的治疗策略(推荐级别:强)。这也为该案例患者后续提供了免疫治疗的共识依据!
整体来说,由于在NSCLC中较低的发生率,BRAF非V600E突变患者是一个相对罕见的群体,也缺乏指南推荐的标准治疗方案,然而,跨适应症靶向用药、免疫治疗等临床研究所给出的积极成果,为他们鼓舞了治疗信心。也期待后续更多相关临床研究结果公布,更好指导临床实践,惠及更多BRAF非V600E突变NSCLC患者。
参考文献:
[1]B. Jia , J. Zhao , B. Jin et al. Prevalence, clinical characteristics, and treatment outcomes of patients with BRAF-mutated advanced NSCLC in China: a real-world multi-center study. 2023 ELCC 36P.
[2]中国抗癌协会肺癌专业委员会. 中国晚期非小细胞肺癌BRAF突变诊疗专家共识 [J] . 中华肿瘤杂志, 2023, 45(4) : 279-290. DOI: 10.3760/cma.j.cn112152-20230117-00030.
[3]Lazar R, Fischbach C, Schott R and Somme L (2024) Outcomes of non-small cell lung cancer patients with non-V600E BRAF mutations: a series of case reports and literature review. Front. Oncol. 14:1307882.doi: 10.3389/fonc.2024.1307882
[4]Sheikine Y, Pavlick D, Klempner SJ, Trabucco SE, Chung JH, Rosenzweig M, Wang K, Velcheti V, Frampton GM, Peled N, Murray M, Chae YK, Albacker LA, Gay L, Husain H, Suh JH, Millis SZ, Reddy VP, Elvin JA, Hartmaier RJ, Dowlati A, Stephens P, Ross JS, Bivona TG, Miller VA, Ganesan S, Schrock AB, Ou SI, Ali SM. BRAF in Lung Cancers: Analysis of Patient Cases Reveals Recurrent BRAF Mutations, Fusions, Kinase Duplications, and Concurrent Alterations. JCO Precis Oncol. 2018 Apr 19;2:PO.17.00172. doi: 10.1200/PO.17.00172. PMID: 32913992; PMCID: PMC7446447.
[5]Riely GJ, Smit EF, Ahn MJ, Felip E, Ramalingam SS, Tsao A, Johnson M, Gelsomino F, Esper R, Nadal E, Offin M, Provencio M, Clarke J, Hussain M, Otterson GA, Dagogo-Jack I, Goldman JW, Morgensztern D, Alcasid A, Usari T, Wissel P, Wilner K, Pathan N, Tonkovyd S, Johnson BE. Phase II, Open-Label Study of Encorafenib Plus Binimetinib in Patients With BRAFV600-Mutant Metastatic Non-Small-Cell Lung Cancer. J Clin Oncol. 2023 Jul 20;41(21):3700-3711. doi: 10.1200/JCO.23.00774. Epub 2023 Jun 4. PMID: 37270692.
[6]Sharp JA, Jones D, Rotow JK, Fidias PM, Bertino E, Owen DH. Response to Dabrafenib Plus Trametinib in a Patient With an Uncommon Activating BRAF Mutation: A First in Non-Small Cell Lung Cancer. J Natl Compr Canc Netw. 2024 Mar 13;22(3):e247009. doi: 10.6004/jnccn.2024.7009. PMID: 38479107.
[7]Ding X,Zhang ZL,Jiang T,et al. Clinicopathologic characteristies and outcomes of Chinese patients with non-small-cell lung cancer and BRAF mutation[J]. Cancer Med, 2017,6(3):555-562.DOl:10.1002/cam4.1014.
[8]Negrao MV, Skoulidis F, Montesion M, Schulze K, Bara I, Shen V, Xu H, Hu S, Sui D, Elamin YY, Le X, Goldberg ME, Murugesan K, Wu CJ, Zhang J, Barreto DS, Robichaux JP, Reuben A, Cascone T, Gay CM, Mitchell KG, Hong L, Rinsurongkawong W, Roth JA, Swisher SG, Lee J, Tsao A, Papadimitrakopoulou V, Gibbons DL, Glisson BS, Singal G, Miller VA, Alexander B, Frampton G, Albacker LA, Shames D, Zhang J, Heymach JV. Oncogene-specific differences in tumor mutational burden, PD-L1 expression, and outcomes from immunotherapy in non-small cell lung cancer. J Immunother Cancer. 2021 Aug;9(8):e002891. doi: 10.1136/jitc-2021-002891. PMID: 34376553; PMCID: PMC8356172.



