Cell:突破器官移植瓶颈:干细胞胚胎模型与异种器官发生的前沿探索
时间:2024-06-29 06:03:23 热度:37.1℃ 作者:网络
引言
再生医学领域中,利用干细胞(stem cells)发展功能性器官仍然是一个重大挑战。目前已有的方法如组织工程(tissue engineering)、生物打印(bioprinting)和类器官技术(organoids)只能提供部分解决方案。6月20日Cell杂志的报道“Toward developing human organs via embryo models and chimeras”展望了两个有望从干细胞中构建人体器官的新兴方法:基于干细胞的胚胎模型(embryo models)和异种器官发生(interspecies organogenesis)。这两种方法都是通过引导干细胞模仿自然发育过程,从而实现器官的工程化。
器官移植是治疗终末期肾、肝、心和肺衰竭等危及生命的疾病的唯一可行方法,但全球器官捐赠短缺加剧了这一问题。在美国,仅在国家移植等待名单上的人就超过10万人,每天有17人在等待器官移植过程中去世。这种捐赠器官的短缺促使医生和科学家寻找替代解决方案,包括使用与人类器官在解剖和生理上相似的动物器官进行异种移植(xenotransplantation)。尽管在利用转基因动物器官进行异种移植疗法方面取得了一些进展,如使用猪的器官,但动物器官是否适合长期人类移植仍然存在不确定性。
除异种移植外,还有其他基于培养的人体细胞的器官工程策略,包括组织工程、生物打印和类器官技术。数十年的组织工程研究已经成功应用于各种工程化组织构建,最近的应用包括用于皮肤病治疗和视力恢复的皮肤和角膜组织移植。另一种新兴的组织工程方法利用不同器官的脱细胞外基质(extracellular matrix, ECM)来提供支持生物人工器官生成的仿生支架。生物打印可以精确沉积含有细胞的生物墨水(bioinks)和支撑结构,以创建具有无与伦比的拓扑复杂性的三维(3D)组织架构。类器官是从自组织的组织特异性干细胞和前体细胞衍生的3D结构,显示出在模拟人体器官发育和疾病方面的巨大潜力。
尽管基于组织工程、生物打印和类器官技术的器官工程研究日益复杂,但它们仍存在一些不足之处。例如,它们在再现重要的功能元素(如血管、神经、淋巴系统)以及实体器官中不同胚层谱系的功能和支持细胞类型的数量、多样性和组织方面存在不足。
该报道展望了两种基于人类干细胞的尖端策略,这些策略有望解决器官工程中的挑战:基于干细胞的胚胎模型和异种器官发生。这两种方法都基于一个统一的概念框架,强调再现胚层谱系发育和组织及器官形成所需的微环境的自然过程。模拟自然胚胎发育的轨迹,这两种方法可以在理论上使人类器官在接近其自然生长条件的环境中发育,无论是由胚胎模型本身提供还是在异种宿主中提供。
尽管目前通过胚胎建模和异种器官发生尚未生成功能性人类器官,该报道旨在总结这两个领域的最新进展,并展望它们在再生医学中的应用前景。
再生医学领域的一个重要目标是通过干细胞(stem cells)发展功能性器官。虽然已有的方法如组织工程(tissue engineering)、生物打印(bioprinting)和类器官技术(organoids)已经取得了一些进展,但它们在再现复杂器官的结构和功能方面仍存在显著的不足。该报道探讨了两个新兴的、有潜力的策略:基于干细胞的胚胎模型(embryo models)和异种器官发生(interspecies organogenesis),它们有望在未来的器官工程中发挥重要作用。
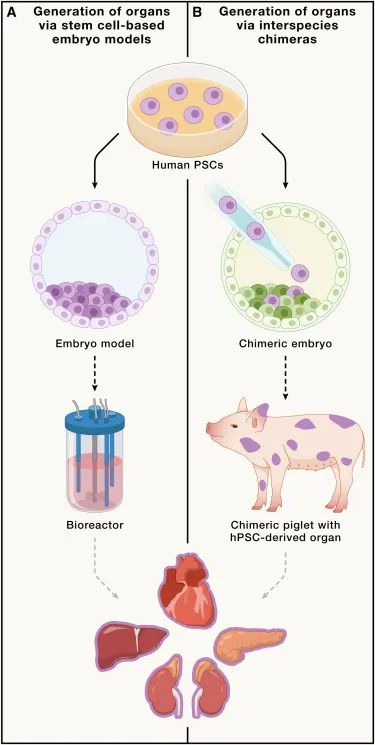
从多能干细胞(PSCs)创造人类器官的两种创新策略的示意图(Credit: Cell)
基于干细胞的胚胎模型
基于干细胞的胚胎模型是利用干细胞模仿胚胎发育过程,试图在体外培养环境中形成器官原基。干细胞具有显著的自组织能力,能够在特定条件下分化形成多细胞结构,这些结构在某些方面类似于早期胚胎组织。研究人员利用这一特性,通过优化培养条件和生物工程手段,尝试再现从胚层形成(gastrulation)到器官生成(organogenesis)的复杂过程。
近年来,鼠胚胎模型取得了显著进展。这些模型通过将小鼠胚胎干细胞(mESCs)和滋养层干细胞(TSCs)结合在特定的培养环境中,成功再现了胚层分化和早期器官生成的一些关键步骤。例如,通过将mESCs和TSCs组合在一起,研究人员能够模拟胚胎早期阶段的发育过程,包括胚层形成和器官原基的发育。这些鼠胚胎模型不仅在结构上类似于自然胚胎发育过程,还在某些功能上展现出相似的特征。
然而,这些模型也存在一些显著的问题。首先,器官原基的结构常常表现出缺陷和变异,例如大小不均、形态异常等。此外,这些模型在再现血管和神经等复杂组织结构方面仍存在不足,无法完全模仿自然胚胎发育的全部过程。因此,虽然鼠胚胎模型为研究胚胎发育和器官生成提供了有价值的工具,但在实现功能性器官生成方面仍需进一步改进和优化。
异种器官发生
异种器官发生是指将人类干细胞植入动物胚胎中,通过利用动物宿主的自然发育环境,生成具有功能性的人类器官。这一策略的关键在于选择适当的动物宿主和优化人类干细胞的植入方法。近年来,研究人员在猪等大型动物中进行了一系列实验,尝试生成功能性的人类组织和器官。
异种器官发生的一个成功案例是利用基因编辑技术创建了缺乏关键器官生成基因的猪胚胎,并将人类诱导多能干细胞(hiPSCs)植入其中,生成了部分人类细胞组成的器官。例如,研究人员通过基因编辑技术敲除猪胚胎中的MYF5、MYOD和MYF6基因,这些基因对于肌肉组织的生成至关重要。然后,他们将hiPSCs植入这些基因敲除的猪胚胎中,成功生成了含有人类细胞的肌肉组织。这些实验展示了异种器官生成的可行性,但人类细胞在动物胚胎中的整合效率和器官功能性仍需进一步研究。
此外,异种器官发生的另一个成功案例是利用猪胚胎生成含有人类细胞的血管组织。研究人员通过基因编辑技术敲除猪胚胎中的ETV2基因,这一基因对于血管生成至关重要。然后,他们将hiPSCs植入这些基因敲除的猪胚胎中,成功生成了含有人类细胞的血管组织。这些实验进一步证明了异种器官发生的潜力,但仍需解决一系列技术和伦理问题。
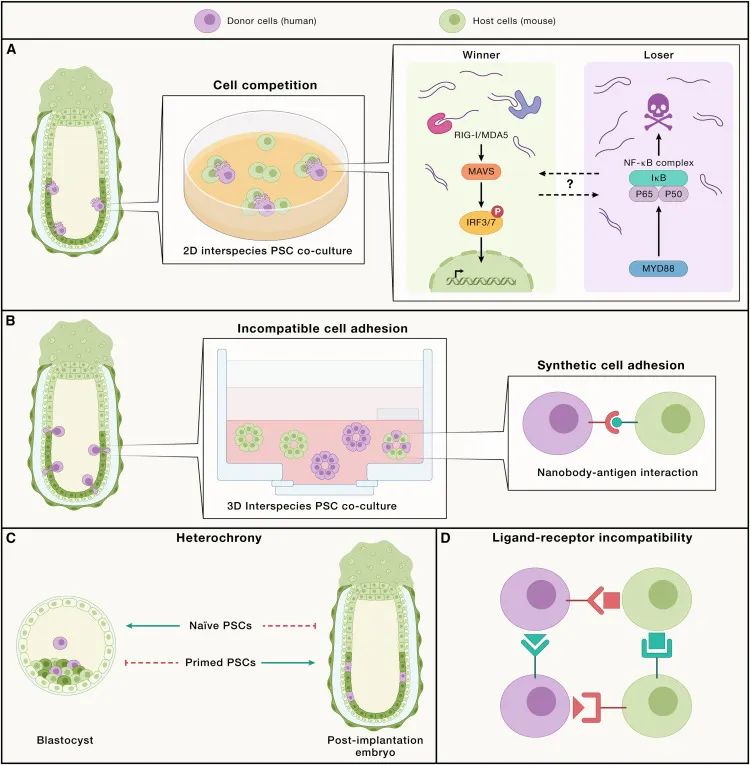
异种间(xenogeneic)障碍的问题(Credit: Cell)
物种间竞争(A):在不同物种的干细胞(PSC)共同培养实验中,尤其是进化上相距较远的物种(例如人类-小鼠、人类-牛、人类-大鼠),发现了显著的竞争互动。例如,当人类干细胞(PSC)与小鼠胚胎干细胞(EpiSCs)共同培养时,人类干细胞往往会被淘汰,这一过程受到NF-κB信号通路的控制。通过在人的细胞中禁用P65基因(也称为RELA)或NF-κB复合体的上游调节因子(MYD88),可以克服这种竞争,从而提高人类细胞在早期小鼠胚胎中的存活率和嵌合能力。在胜者细胞(例如小鼠EpiSCs)中,视黄酸诱导基因I(RIG-I)样受体(RLR)信号通路(一种RNA传感器)在确定小鼠和人类PSC共同培养的竞争结果中起重要作用。
细胞黏附不兼容性(B):特别是不同物种的初级PSC之间的细胞黏附不兼容性,构成了一个显著的异种间障碍。利用3D物种间PSC共同培养提供了一种有价值的体外方法来研究这一障碍。克服这一问题的一个显著方法是工程化合成细胞黏附,可以通过利用膜锚定的纳米抗体-抗原相互作用来促进不同物种PSC之间的细胞黏附兼容性。
异时性(C):异时性(heterochrony)是另一个异种间障碍。为了成功生成种内和种间嵌合体,匹配供体PSC与宿主胚胎的发育时间是一个重要的考虑因素。
基因组进化导致的配体-受体配对不匹配(D):基因组进化导致的配体-受体对不匹配构成了另一个异种间挑战。
基于干细胞的胚胎模型和异种器官发生展示了在再生医学领域的巨大潜力。胚胎模型通过模仿自然发育过程,有望在体外培养条件下生成复杂的器官结构;异种器官发生则通过借助动物宿主的发育环境,有望解决目前器官移植供体短缺的问题。然而,这两种方法在实现功能性器官生成方面仍面临诸多挑战。
对于胚胎模型,主要的挑战在于如何提高其发育效率和再现性。目前,胚胎模型的发展依赖于干细胞的自组织和分化能力,但这些过程往往受到培养环境和细胞间相互作用的影响,导致模型的结构和功能变异较大。未来,结合先进的生物工程手段,如微模式化技术(micropatterning)、微流控技术(microfluidics)和三维生物打印,有望提高胚胎模型的精确度和再现性。
对于异种器官发生,主要的挑战在于如何克服物种间的生物学障碍,提高人类细胞在动物宿主中的整合效率。尽管基因编辑技术已经显著提高了人类细胞在动物胚胎中的植入成功率,但这些器官的长期功能性和免疫相容性仍需进一步研究。此外,异种器官发生涉及的伦理问题也需要得到充分的讨论和解决。
尽管面临诸多挑战,基于干细胞的胚胎模型和异种器官发生在再生医学领域仍具有广阔的应用前景。随着技术的不断进步,研究人员有望解决当前存在的技术瓶颈,实现功能性人类器官的生成,为器官移植和疾病治疗提供新的解决方案。
未来的研究方向包括:优化干细胞的培养和分化条件,提高胚胎模型的再现性和发育效率;通过基因编辑技术和生物工程手段,进一步提高人类细胞在动物宿主中的整合效率和功能性;开展广泛的伦理讨论,制定相关法规和指导原则,确保科学研究的可持续发展。
基于干细胞的胚胎模型和异种器官发生为再生医学的发展提供了新的思路和方法。尽管目前仍存在诸多挑战,但随着技术的不断进步和科学家的不懈努力,这两种策略有望在未来实现功能性人类器官的生成,为器官移植和再生医学带来革命性的变化。
参考文献
Wu J, Fu J. Toward developing human organs via embryo models and chimeras. Cell. 2024 Jun 20;187(13):3194-3219. doi: 10.1016/j.cell.2024.05.027. PMID: 38906095.
https://doi.org/10.1016/j.cell.2024.05.027


