Sci Adv:基于高通量单细胞分析揭示小鼠整个生命周期的线粒体DNA异质性
时间:2023-12-05 10:39:33 热度:37.1℃ 作者:网络
突变是遗传性疾病的主要原因,并会导致常见的晚发性疾病。大多数低水平的异质mtDNA突变是良性的或没有功能影响,但当突变分子的比例(异异质性分数)超过临界生化阈值时,致病性突变就会导致细胞功能障碍或细胞死亡。这个阈值是突变和细胞类型特异性的。mtDNA相关疾病的晚发和临床进展被认为是由于异质性水平的改变,但尚不清楚是如何发生以及何时发生的,且大规模单细胞异质性检测也具有挑战性。
来自英国剑桥大学和纽卡斯尔大学的研究团队合作在Science Advances发表了题为“High-throughput single-cell analysis reveals progressive mitochondrial DNA mosaicism throughout life”的文章。研究团队在两种人类mtDNA疾病小鼠模型中进行了高通量单细胞基因分型,发现了mtDNA异质性水平在细胞间存在意想不到的差异,这些差异在产前出现,并在整个生命过程中逐渐增加。增殖性脾细胞和非分裂性脑细胞具有相似的单细胞异质性差异,表明mtDNA或细胞器周转是决定细胞异质性水平的主要推动力。研究发现两种不同的mtDNA突变以不同的速率分离,与体内随机遗传漂变的不同速率一致,导致以不同的速率积累具有非常高突变负荷的细胞。这为相似mtDNA突变引起的人类疾病的严重程度差异提供了解释。

文章发表在Science Advances
单细胞水平的极端mtDNA异质性
研究团队分析线粒体转移RNA丙氨酸(tRNAAla或mt-Ta)基因中携带异质性m.5024C>T mtDNA突变的小鼠。除了从大量组织样本中提取DNA,研究人员还建立了高通量组织解离和荧光激活细胞分选(FACS)流程,用于分离完整的单细胞进行单个mtDNA基因分型(图1A)。对产后100天成年小鼠(P100)的初步分析显示,三只m.5024C>T小鼠的组织间异质可变性较低(图1B)。随后研究团队分析了不同细胞的异质性水平分布。当将来自同一动物的细胞(pseudo-bulk)分组在一起时,每个单细胞分布的平均值在bulk组织检测值的5.16%以内,与单细胞基因分型的技术可变性保持一致。虽然组织和器官之间的平均水平相似,但脾脏和大脑细胞类型的单细胞异质性水平差异很大,大脑为40.5%~75%,脾脏为35.75%~67%(图1C)。
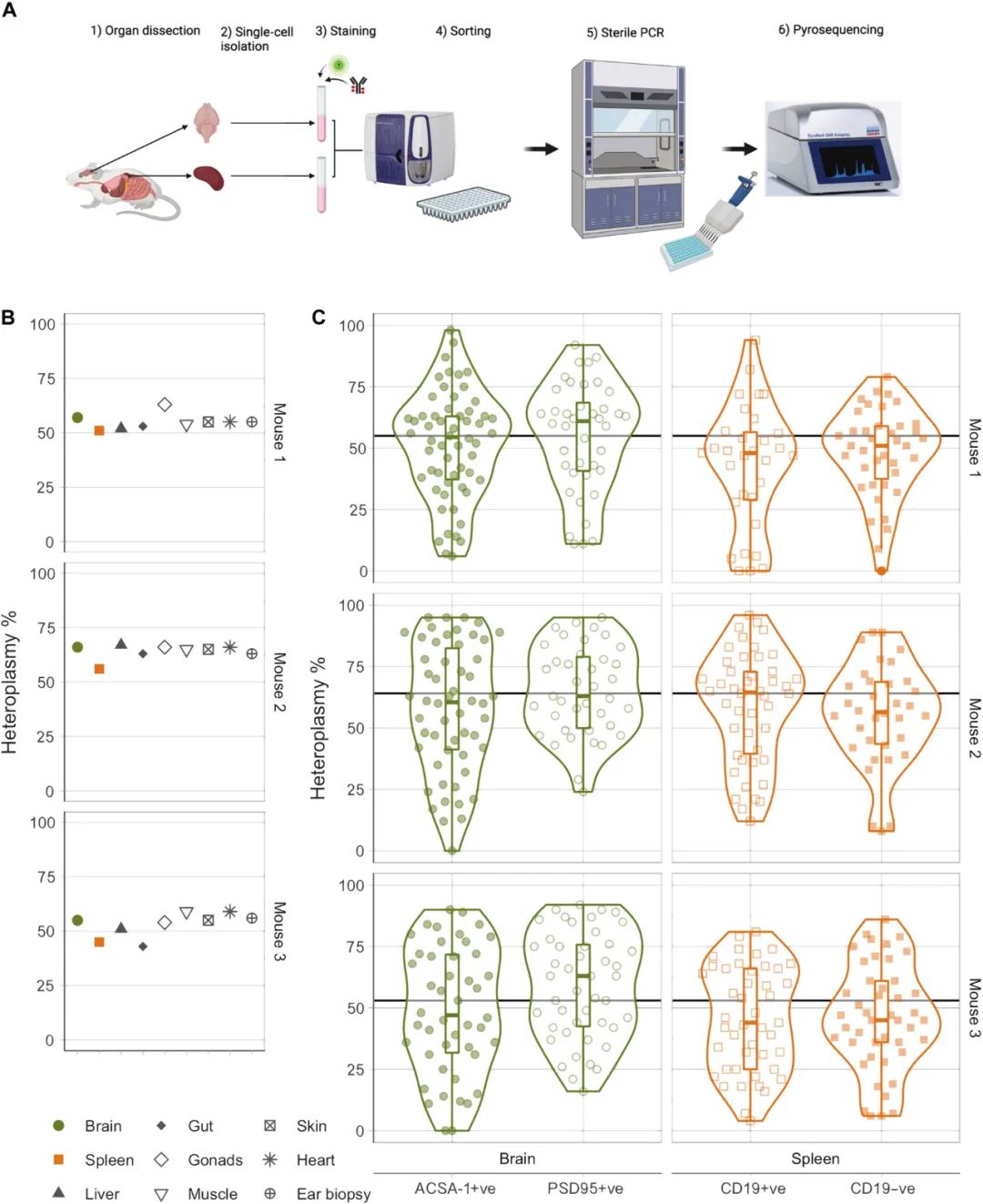
图1. 线粒体疾病成年小鼠模型的脾脏和大脑中发现了极端的细胞异质性。
分裂和有丝分裂后组织中单细胞异质性水平随年龄的变化
研究人员对新生幼崽(P0,n=3只,n=474个细胞)、6天大的幼崽(P6,n=3只,n=463个细胞)和1岁大的小鼠(P365,n=3,n=540个细胞)进行了类似的检测,探索细胞异质性值范围是否从出生开始就存在或在整个生命过程中发生变化。与之前相同,跨多个组织的主要异质值是相似的(图2A),并且每种细胞类型的单细胞异质性水平范围很广(图2B)。但是,研究人员在P0小鼠中仅检测到2个同质细胞(0.42%),在P365小鼠中检测到49个同质细胞(9.07%),这与出生后到整个成年期mtDNA异质性的持续分离一致。简言之,产前至成年后期单细胞异质性差异有所增加,异质性与每只小鼠和每种组织中的平均异质性水平无关。
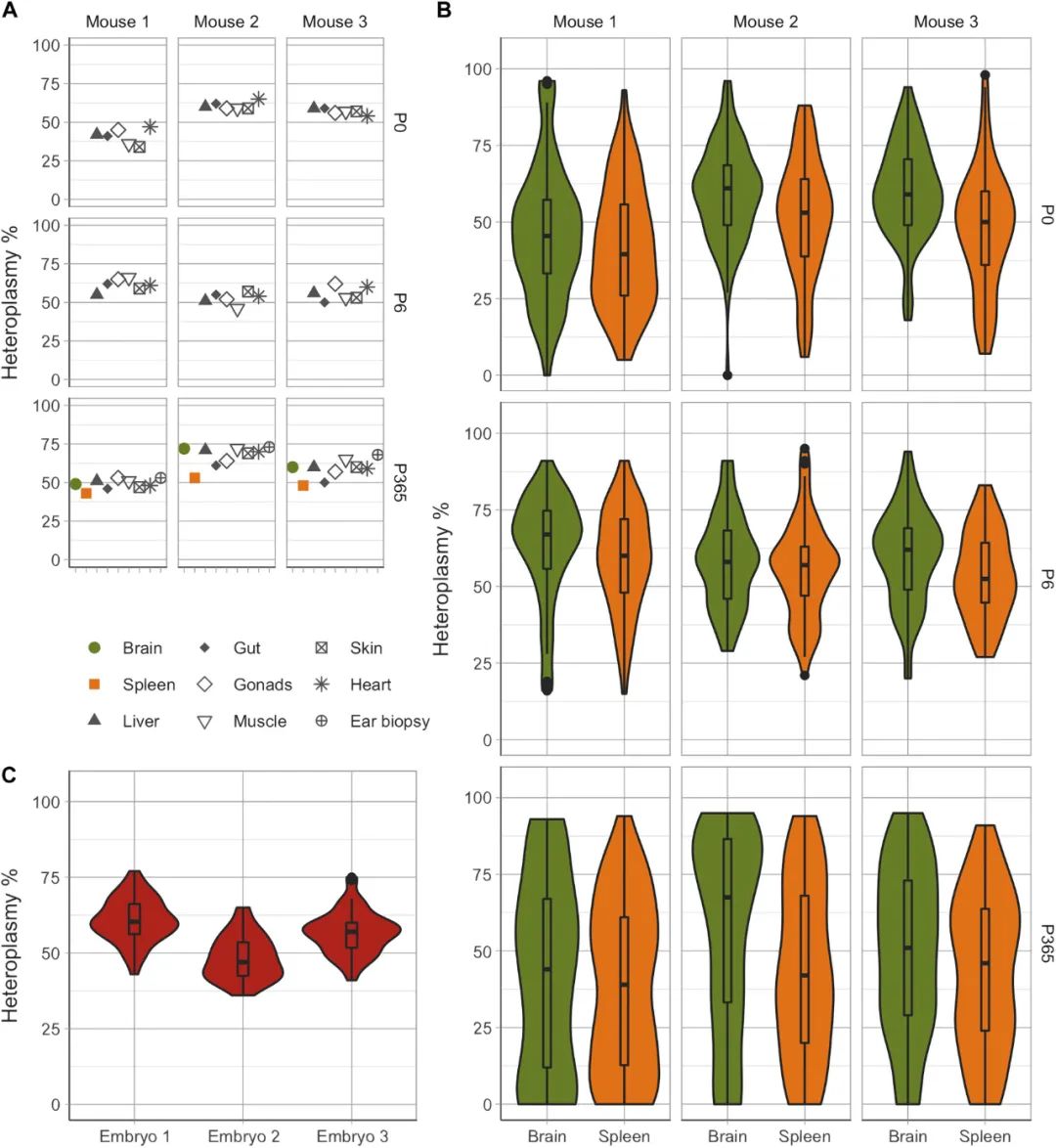
图2. m.5024C>T小鼠大脑和脾脏中单细胞异质性的变异性随着年龄的增长而增加。
分裂和有丝分裂后组织中同质细胞的突变依赖性积累
研究人员从携带m.5019A>G突变的小鼠身上收集了数据。该突变也影响mt-Ta,与m.5024C>T相反,该突变不影响tRNA的稳定性,通过其氨基酰化缺陷损害线粒体氧化磷酸化(OXPHOS)。从m.5024C>T结果可以看出,在三只成年(P100)小鼠中,不同组织中的大部分异质性水平相似(图3A),在每种类型的592个细胞中观察到了单细胞水平的广泛异质性(IQR,脑81.25%~98%,脾74%~97%;图3B)。与m.5024C>T不同,m.5019A>G的同质细胞比例较高。
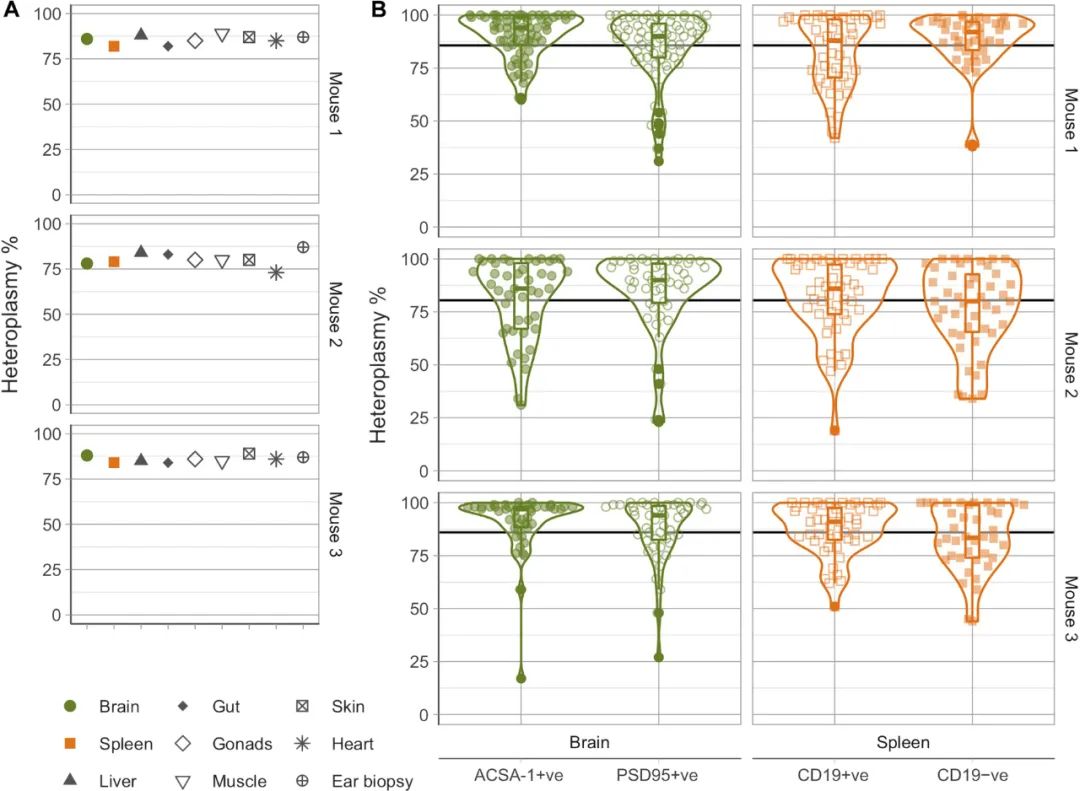
图3. 携带致病性m.5019A>G突变的成年小鼠大脑和脾脏中突变型同质细胞的体内突变依赖积累。
将这些异质性扩展到整个生命过程中(从小鼠胚胎到成年)来观察,发现老年小鼠的细胞异质性值的方差增加,胚胎的归一化方差最低。可见,mtDNA异质性在分裂细胞和非分裂细胞中的渐进分离并不局限于m.5024C>T突变。与m.5024C>T一样,在脾脏和大脑细胞中,m.5019A>G的总体异质性分布具有可比性。
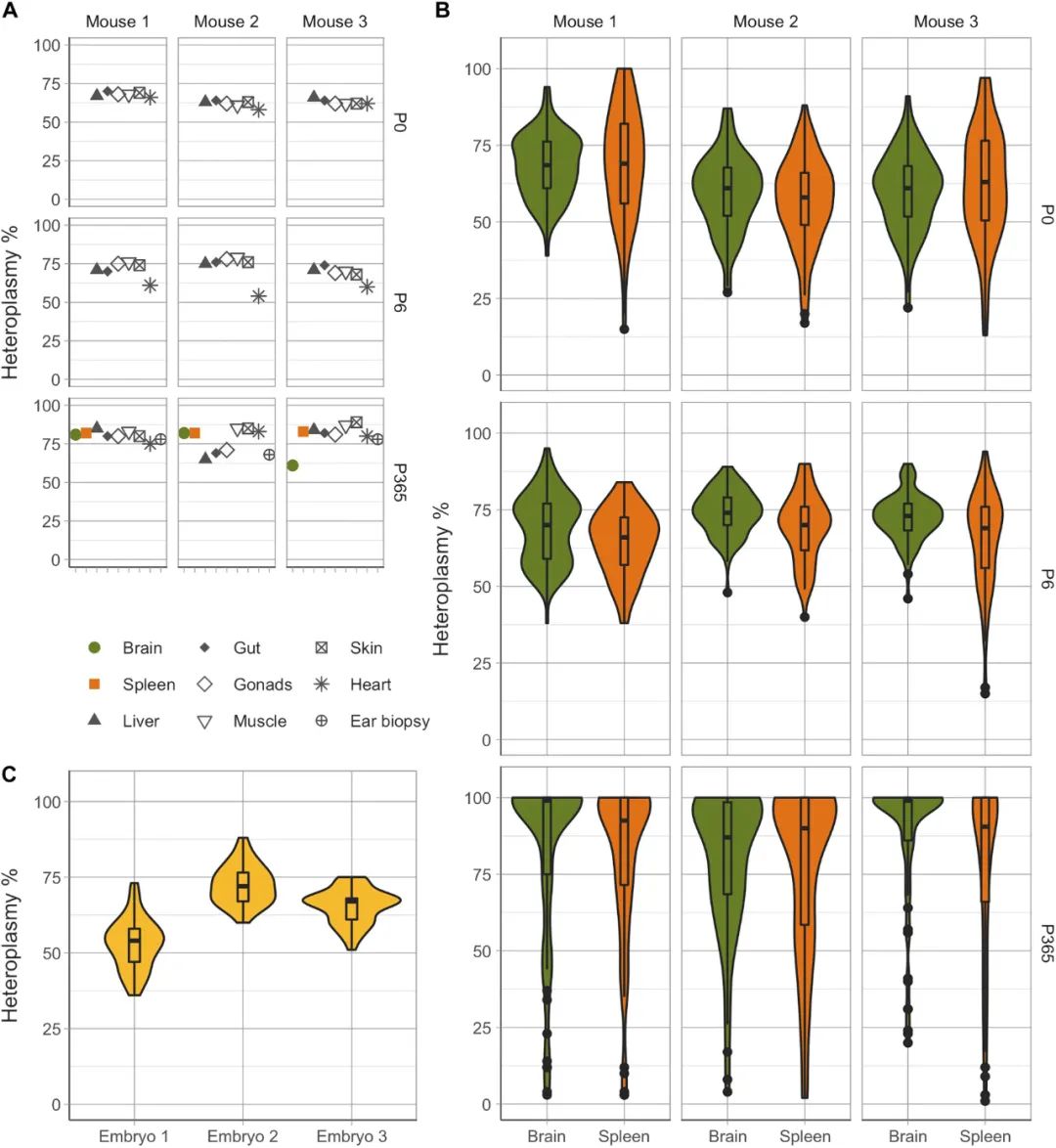
图4. 单细胞水平上异质性突变的快速增加导致m.5019A>G小鼠大脑和脾脏中同质细胞的年龄依赖性积累。
随机遗传漂变引起的同质细胞的年龄依赖性积累
为了探索观察到的分离(segregation)背后的机制,研究人员将检测到的bulk异质性值与计算出的每个组织中两种突变(或“pseudo-bulk”)的平均单细胞异质性值进行了比较(图5)。检测的bulk异质性水平和pseudo-bulk值之间存在强相关性,表明分离的细胞代表整个器官,并与主要由随机遗传漂变驱动的机制相一致。虽然从P6开始,观察到异质性方差增加的总体趋势(图5C),但m.5024C>T和m.5019A>G小鼠的增加率不同。此外,通过比较不同组织间的异质性差异,m.5024C>T和m.5019A>G小鼠的脾脏和脑的单细胞异质性值的方差在不同时间点上没有差异。
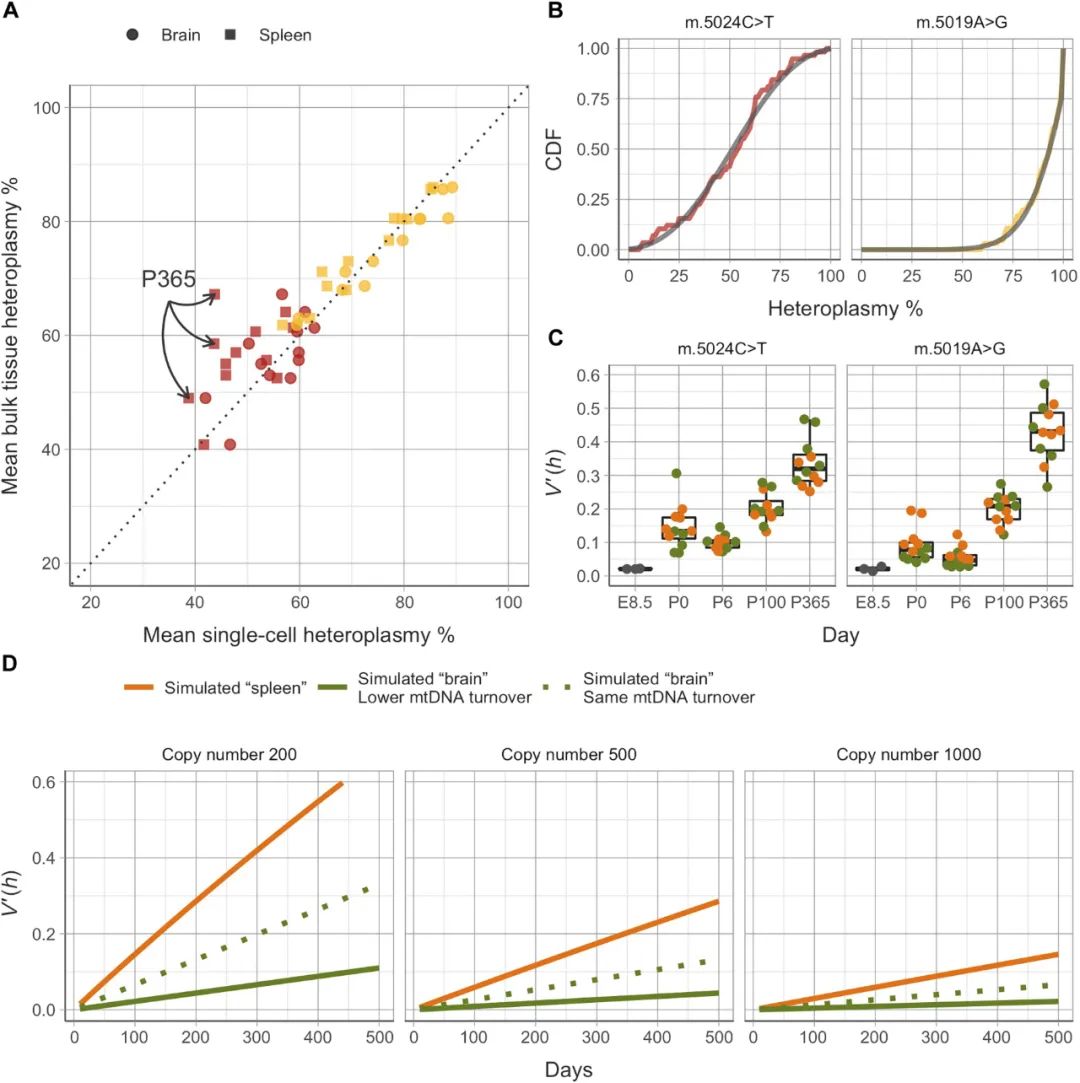
图5. 随机遗传漂变导致具有极端异质性值细胞的年龄和突变依赖性积累。
综上,研究团队通过检测约4,500个单细胞中的mtDNA异质性,发现在两种不同的mtDNA疾病动物模型中,单细胞异质性水平的差异在小鼠的一生中均有增加。对于两种突变和检测的两种组织,单细胞异质性水平与主要由随机遗传漂变控制的机制一致。在患有mtDNA疾病的人类中,高异质性细胞群体的微小变化可能会导致疾病进展。两种不同的mtDNA突变以不同的速率分离,导致了具有高突变负荷细胞的积累速率不同,这就可以解释为什么类似的mtDNA突变引起的人类疾病具有不同的严重程度。以上发现揭示了不同细胞群中异质性分离机制,有可能对降低突变负荷疗法的开发提供支持。
原始出处:
Glynos, Angelos et al. “High-throughput single-cell analysis reveals progressive mitochondrial DNA mosaicism throughout life.” Science advances vol. 9,43 (2023): eadi4038. doi:10.1126/sciadv.adi4038.https://www.science.org/doi/full/10.1126/sciadv.adi4038


