浙大王慧明教授《AM》:金属有机框架+骨髓干细胞用于梗死心肌恢复
时间:2023-11-18 21:19:54 热度:37.1℃ 作者:网络
在过去的几十年里,组织工程领域已经做出大量努力,以细胞为基础的治疗方法覆盖神经、骨骼、软骨和心脏组织。非生物物质与活细胞的整合已经成为控制细胞功能的一个令人兴奋的策略。因此,浙江大学王慧明教授、俞梦飞教授和Miao Sun提出由金属有机框架(MOFs)组成外骨骼,以产生部分涂层的骨髓干细胞(BMSCs),以克服低细胞存活率导致的基于细胞心脏治疗令人失望的效果。部分涂层的外骨骼可以通过整合外骨骼的支持和未受损的细胞特性来促进悬浮的BMSCs存活。
此外,部分外骨骼对有害环境条件表现出保护作用,包括ROS(活性氧)、pH值变化和渗透压。在细胞治疗过程中,部分涂层细胞表现出增加的细胞间粘附力来聚集和粘附,促进细胞存活,防止细胞逃逸。外骨骼与细胞表面受体整合素α5β1相互作用,导致生物学功能增强,基因表达改变,如Vegfa、Cxcl12和Adm。部分涂层的BMSCs显示梗死心肌细胞保留增强。心肌梗死修复通过改善心肌功能、心肌血管生成、增殖和抑制细胞凋亡而实现。
这一发现促进了细胞-外骨骼相互作用的潜在分子和细胞机制的阐明,并有利于下一代纳米生物杂交体的合理设计和制造。相关研究内容以题为“Exoskeleton Partial-Coated Stem Cells for Infarcted Myocardium Restoring”的论文于2023年11月14日发表在《Advanced Materials》。

本研究使用一种简单而通用的方法,用沸石咪唑酸盐框架(8(ZIF-8)纳米颗粒涂层部分包裹BMSCs(骨髓干细胞)。部分涂层的壳允许细胞粘附、扩散和信号转导,诱导支持外骨骼和细胞功能的整合(示意图)。本研究为外骨骼调控细胞命运提供新见解,并为实际生物医学应用提供外骨骼-细胞杂交提供更深入的理解。
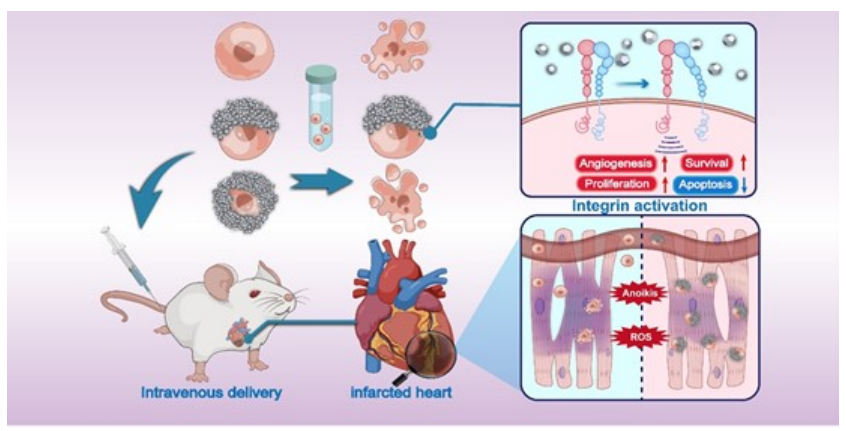
示意图 部分涂层的BMSCs具有增加生存、保留和增强心肌梗死治疗的生物学能力方案
【悬浮环境下的细胞存活】
在明亮视野显微镜和扫描电镜下观察涂层细胞上的外骨骼(图1b)。在红色细胞外的细胞骨架ZIF-8纳米颗粒出现的绿色荧光平均厚度为2.30±0.39μm,显示了具有不同涂层水平的外骨骼-细胞生物杂交体的组装(图1c)。与部分涂层BMSCs相反,全涂层BMSCs在悬浮培养1天后发生凋亡(图1d),3天后出现大量细胞死亡,与裸BMSCs相似(图1e)。此外,BMSCs和全涂层BMSCs在细胞内表现出肌动蛋白的弥漫性染色,而部分涂层BMSCs在培养1天后观察到一些细胞骨架重组(图1f)。部分涂层的BMSCs在整个周期的任何时间点都表现出显著的存活率提高,并保持90%的原始活力,而未涂层的BMSCs存活率约为20%(图1g)。
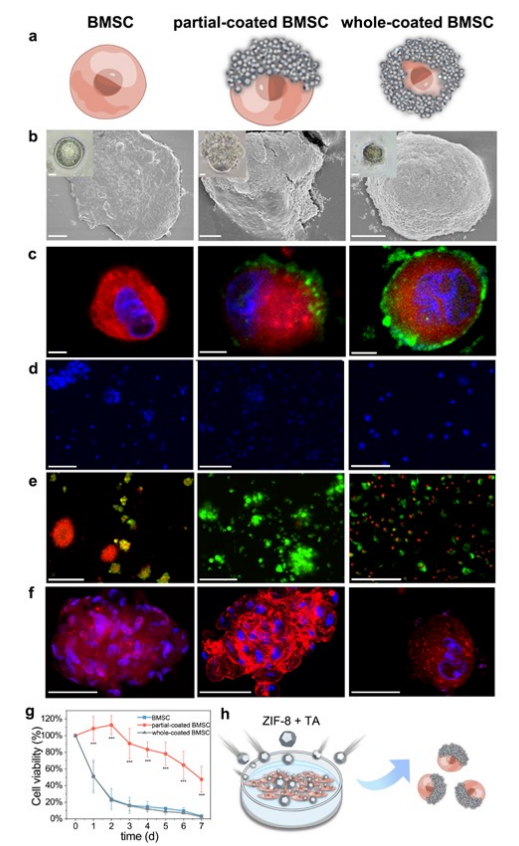
图1 部分外骨骼涂层促进悬浮细胞存活
【有害环境下的细胞特性和耐久性】
BMSCs和部分涂层的BMSCs的傅里叶变换红外(FTIR)光谱如图2a所示。X射线衍射(XRD)结果显示,BMSCs上的ZIF-8外骨架具有典型的衍射峰(图2b)。在传递或打印过程中测试抗剪应力能力,部分涂层的28G针注射实验后,BMSCs保持活力(图2c)。使用0.05-2mM的H2O2来模拟体内氧化应激环境(图2d)。在pH 4-9范围内测试耐酸碱能力,因为病理条件可以改变细胞外的pH,如癌症或炎症(图2e)。在0.25×PBS和2×PBS渗透压条件下,BMSCs的存活率分别下降至24.71%和47.78%(图2f)。经RT-PCR证实,一些与血管生成和细胞存活相关的基因均表达上调,包括Vegfa、Adm、Cxcl12和C-Myc(图2g)。采用ELISA测定上清液中的外分泌蛋白浓度,以验证基因调控是否导致蛋白表达和释放的变化(图2h)。部分涂层的BMSCs释放的蛋白含量明显高于BMSCs,与基因表达的变化相似。综上结果表明,在悬浮培养中,具有外骨骼的细胞处于激活状态,创造一个增强的干细胞治疗平台。
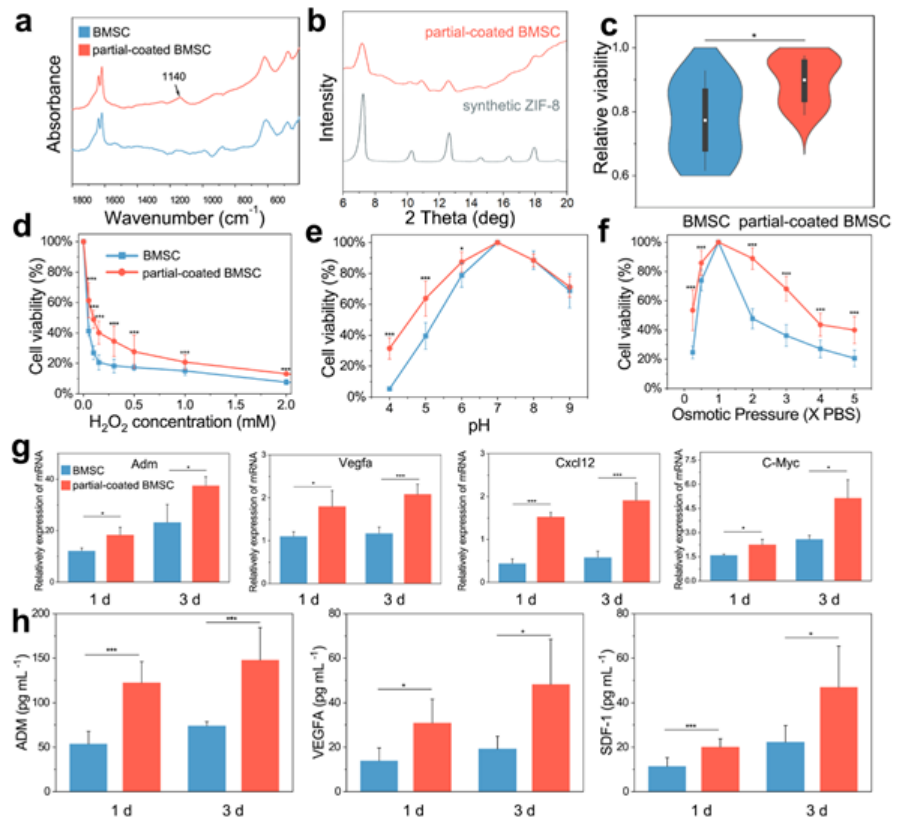
图2 外骨骼部分涂层细胞的表征和优越性能
【增强的粘附能力】
通过修改具有非粘附表面的腔室盖,制作一个包含微电机的微流控装置(图3a)。外骨骼用绿色荧光染色,未被涂层的细胞表面保持红色。相互接触的BMSCs倾向于分离(图3b)。相比之下,当具有绿色外骨骼的细胞与红色轮廓接触时,细胞彼此紧密粘附,最终形成聚集物(图3c)。BMSCs的粘附能力较弱,在观察期间几乎没有任何细胞与类器官相连(图3d)。一段时间后,流动的部分涂层的BMSC贴在类器官上,并随后附着在类器官上,成为聚集的一部分(图3e)。对所有实验的粘附细胞数量进行定量分析(图3f),表明部分涂层的BMSC粘附能力显著提高。在无顶悬臂上捕获单个细胞来制造细胞探针(图3g)。通过自动分析AFM得到的粘附力曲线,测量两个细胞之间的粘附力(图3h)。单个BMSC与部分涂层BMSC的外骨骼表面之间的细胞间粘附力是BMSC之间的许多倍,支持了部分涂层BMSC上的外骨骼对其他BMSC的强粘附力(图3i)。
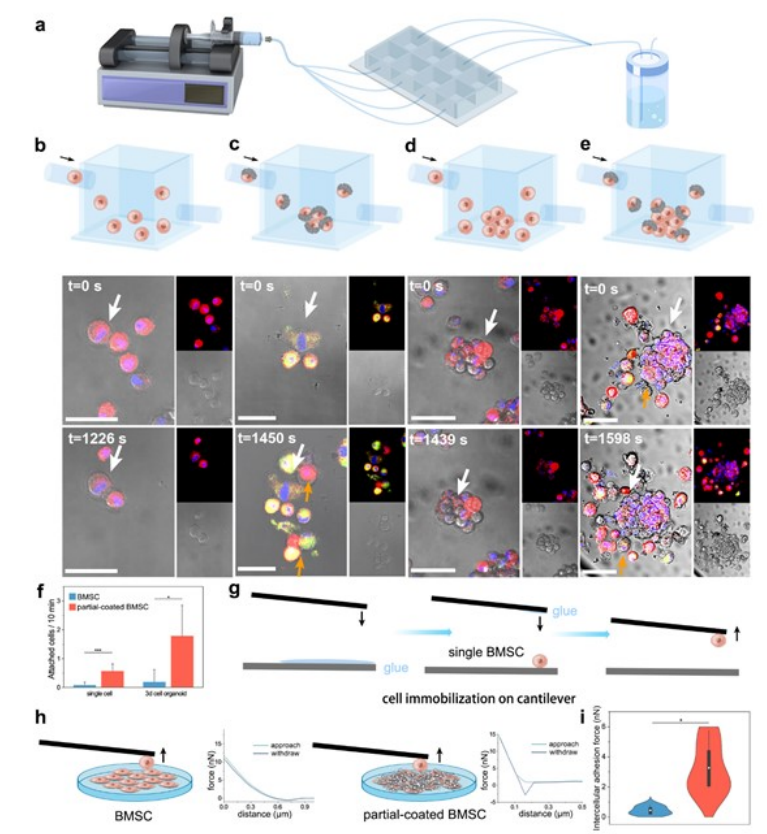
图3 细胞间粘附行为
【外骨骼调节细胞命运】
主成分分析(PCA)显示,各组的基因均在空间上共定位,部分涂层的BMSC的基因与BMSC的基因有较大差异(图4a)。培养1天后,两组间基因表达的差异直接在火山图中可见(图4b)。特别是,部分涂层的BMSC表现出细胞外基质组织、干细胞增殖和VEGF产生的正调控的基因上调(图4c)。GO、KEGG和反应组数据库中差异丰富的基因在与细胞外基质、粘附、细胞骨架和有益信号转导相关的通路中富集(图4d-f)。参与相关通路的基因及其蛋白-蛋白相互作用(PPI)发生显著改变(图4g、h),其中一些与细胞粘附、细胞骨架、血管生成、增殖和凋亡抑制相关的基因进一步上调(图4i)。经过200 ns的MD模拟,整合素α5β1头部的大腿域和PSI域之间的距离增加,表明整合素从封闭构象转变为开放构象(图4j、k)。
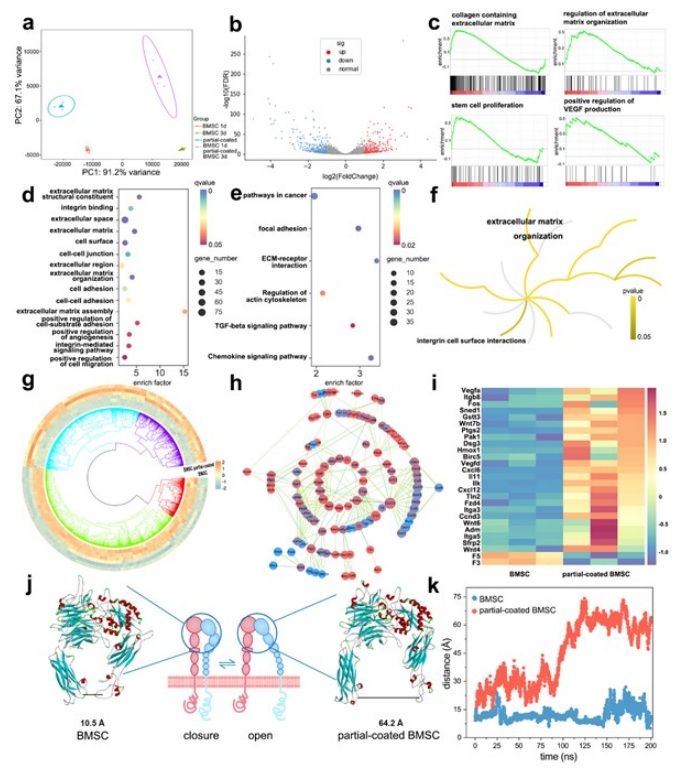
图4 涂层的外骨骼调节细胞命运
【心肌梗死的恢复】
将这些细胞应用于心肌梗死(MI)大鼠,以验证部分涂层的BMSC的治疗效果。分割的BMSC在GelMA水凝胶上广泛聚集,数量明显高于BMSC(图5a),表明它们对心脏组织的靶能力。在体内细胞注射后的不同时间点(2、24和72 h)测量代表细胞分布的平均荧光强度,作为积累的正线性反映(图5b)。心肌梗死大鼠被随机分为三组,并进行2次注射:1) PBS;2)静脉注射BMSC;3)静脉注射部分涂层的BMSC。BMSC处理的大鼠LVEF和LVFS均高于PBS组,但无统计学意义(图5d、e)。对大鼠心脏进行Masson三色染色,以观察梗死的大小和心脏纤维化(图5f)。有心脏重构的梗死区显示蓝色胶原原纤维取代正常心肌。部分涂层BMSC治疗的心脏显示梗死大小最轻,存活心肌数量最高(图5g),从而保持心脏功能。部分涂层的BMSC组在梗死边界区显示出更多的CD31标记的毛细血管和更多成熟的血管(CD31和α-SMA阳性),显示出更好的血管生成能力(图5h、i)。综上,本研究开发了一种具有双面特性的新型生物制剂。外骨骼侧促进细胞的活力和靶向性,而细胞侧保留细胞粘附和外部分泌的组织修复能力。
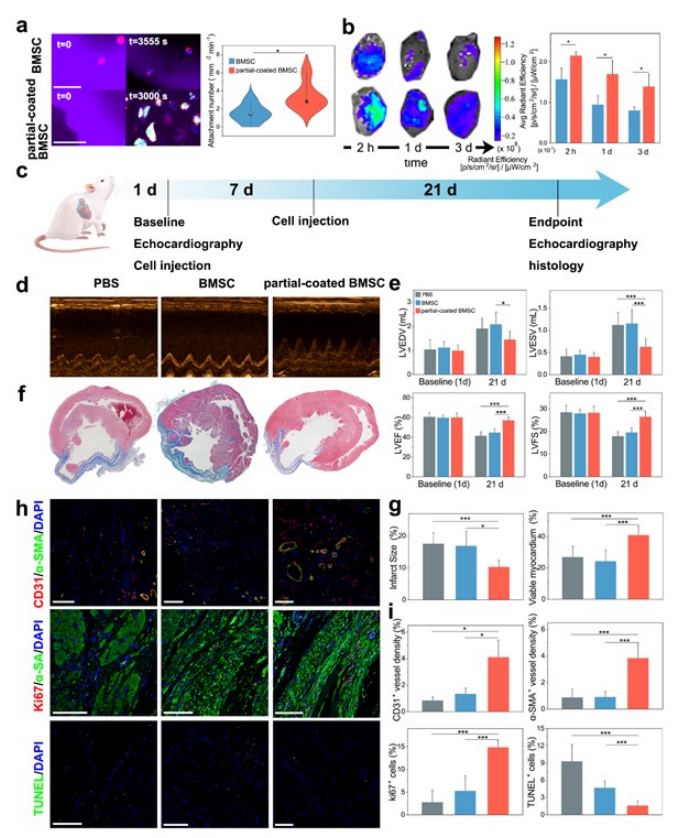
图5 外骨骼部分涂层的BMSC治疗心肌梗死
【总结】
综上所述,部分涂层的BMSC可作为无支架的细胞材料。部分外骨骼作为保护支持,维持细胞在悬浮环境中存活,在悬浮环境中,功能细胞需要苛刻的应用,如基于注射的细胞治疗和3D生物打印。未被涂层的细胞表面维持其原有的粘附、外分泌和细胞间通讯的功能。通过将微/纳米工程与细胞生物学结合起来,部分外骨骼涂层的细胞获得增强的粘附能力和增强的生物学功能。干细胞的低存活率是细胞治疗中的一个重要问题。外骨骼-细胞杂交体由于其优越的生存能力,在细胞治疗领域具有变革性,使纳米生物杂交体成为实际组织工程中一个很有前途的平台。外骨骼介导的对封装细胞生物学特性的操纵有助于将人工外骨架从惰性保护壳提升到作为生物交互附加组件的主动贡献者。
原文链接:
https://doi.org/10.1002/adma.202307169


