mAbs:ADC类药物的临床蓝图
时间:2023-10-05 08:18:10 热度:37.1℃ 作者:网络
ADCs的出现为许多类型的癌症提供了一种有希望的治疗方法。随着越来越多的ADC进入临床试验,该行业正在逐渐从传统的技术逐渐转向更新和更强大技术以开发这种复杂产品。这包括探索新的肿瘤抗原、新抗体结构、新的有效载荷、新的连接子和先进的偶联方法,以此来改善ADC的治疗窗口。从2000年第一款ADC药物获批上市,到2016年仅有3款ADC药物获批上市,但是在随后的几年,ADC的药物迎来了大爆发, DS-8201的出现更是引爆了ADC的开发热情。据统计,截至2023年初,已经有近300款治疗肿瘤的ADC药物进入临床,这药物靶向的靶标达到106种,同时也有部分双抗ADC和双表位ADC进入临床。
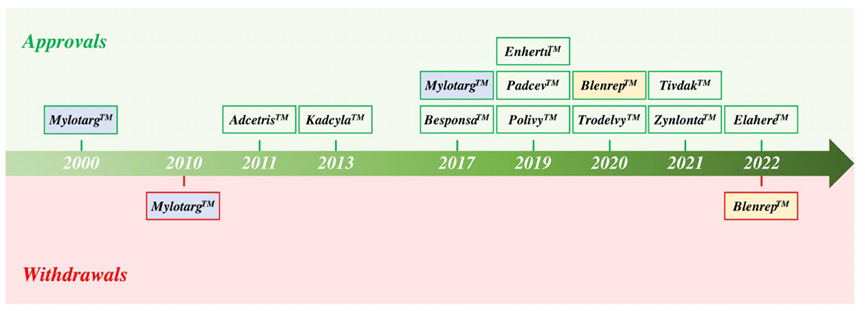
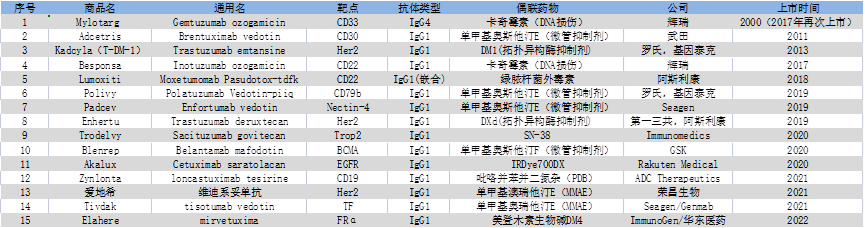
图:FDA 批准的时间表。 迄今为止,已有 12 种 ADC 获得 FDA 批准(绿框)。 MylotargTM 和 BlenrepTM 两种候选药物因未能在批准后试验中达到必要的终点而被撤回批准(红色框)。 MylotargTM 随后以较低剂量与化疗联合重新获得批准。 目前,FDA 批准了 11 种 ADC 疗法。
1、ADC药物临床阶段分布
据统计截至2023年1月,已经有接近300款ADC药物进入临床,其中92款药物因为毒性或者药效不足停止临床,164款正处于临床药物开发中,而到目前已经有15款ADC药物获批上市。而在临床开发中的药物,93款处于临床Ⅰ期,38款处于1/2期临床,17款在临床Ⅱ期,15款已经位于临床2/3或Ⅲ期。

图:经过临床测试的 ADC 的抗原靶标。 在 267 个临床测试的 ADC 中,260 个具有已知抗原(7 个未公开)。 FDA 批准的 ADC(绿色部分,绿色文本)、活性 ADC(蓝色部分,蓝色文本)类别中显示了处于临床测试各个阶段(第 1 阶段 - 第 4 阶段,P1-P4)的针对给定肿瘤抗原的 ADC 数量 )和已停产的 ADC(红色部分,红色文本)。 双抗原靶向 ADC 以斜体显示。 紫色文本所示的 4 期 HER2 候选药物是 disitamab vedotin,已在中国获得批准,尚未获得 FDA 批准。
2、临床药物ADC靶点分布
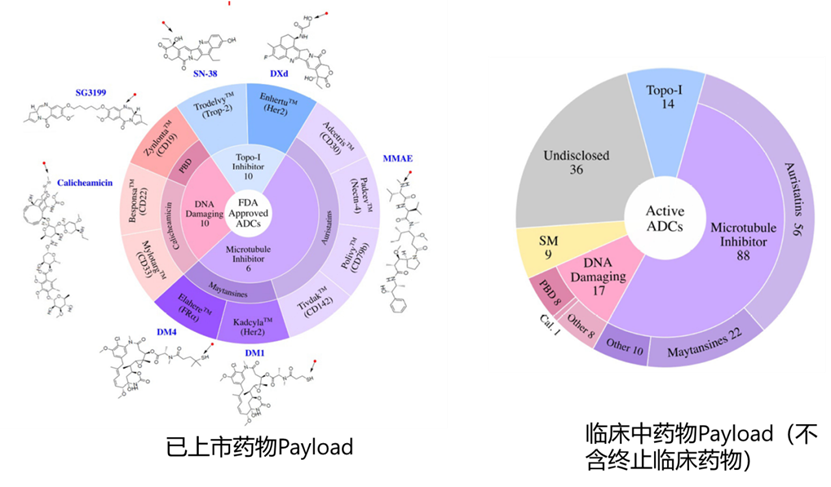
进入临床中ADC 药物的靶点丰富多彩,到2023年1月为止,进入临床的ADC药物共靶向106种不同的肿瘤抗原。获批的11种ADC针对10种不同的癌症抗原: 其中5种adc靶向血液肿瘤抗原,6种靶向实体瘤。而在这些靶向肿瘤的抗原中,位居前四的靶点分别是HER2(41款药物),Trop-2(14款药物) ,CLDN18.2 (11款药物)和EGFR (11款药物)。不到2% 临床ADC候选物针对的抗原表位超过1个肿瘤抗原:四种双特异性ADC,分别靶向EGFR/cMET,EGFR/HER3,EGFR/MUC1和CLDN6/CLDN9和一种双表位ADC(再生元的cMET双抗)。下图红色表示已经终止的临床靶点,蓝色的为正在临床中的ADC靶点,绿色为已经上市的ADC靶点,紫色为临床Ⅳ期的靶点。
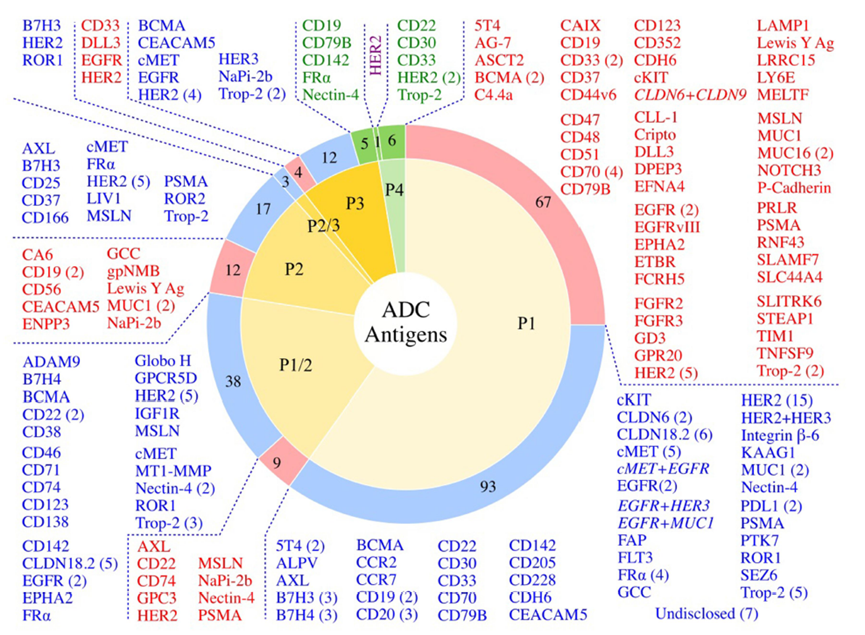
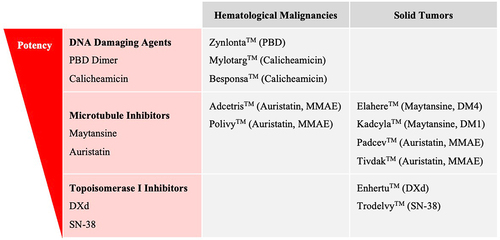
图:批准的 ADC 按有效负载类别和恶性肿瘤设置分类。 提供了批准的 ADC 药物名称和有效负载。 ADC 根据所用有效负载的效力从上到下列出,其中 PBD 有效负载最有效,SN-38 有效负载最弱。
FDA 批准的 ADC 的属性和批准适应症。
3、Linker及Payloads
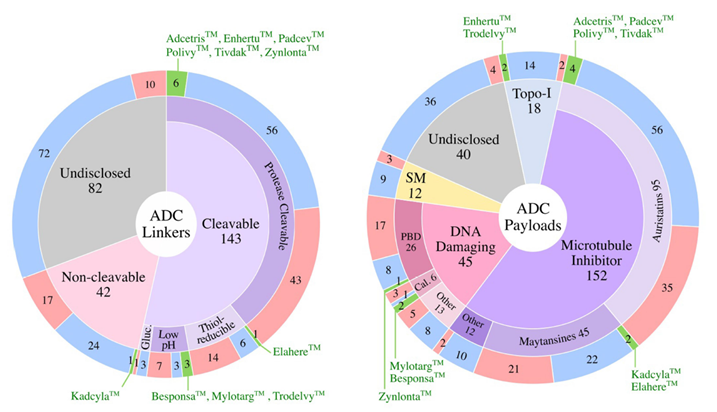
Linker主要分为两大类:可切割linker和不可切割linker。在进入临床的ADC药物中,54%使用可切割连接体, 这也是当下使用最多的一类linker。而且在上市的11个药物中,10个选择了可裂解的linker。而在进入临床的ADC药物中,仅16%使用不可切割linker,已经获批上市的唯一一款不可切割linker的药物为KadcylaTM 。在这些采用可切割的linker中,绝大多数为酶裂解linker,其次为硫醇还原型linker,低pH敏感性型linker。
对于Payloads,传统的ADC Payloads分为三大类:1) 微管抑制剂,2) DNA损伤剂,3) 拓扑异构酶I抑制剂。这些Payloads的效力决定了ADC的功效和毒性。早期ADC候选药物使用活性较低的Payloads (例如,阿霉素,IC50 ~ 10-7 M),最终由于在给药暴露时临床活性不足而被放弃。因此后续ADC领域转向使用活性更高的Payloads,如DNA损伤剂calicheamicin (IC50 ~ 10−10 M)和吡咯苯二氮平类药物(PBDs) (IC50 ~ 10−12 M)和微管抑制剂,如单甲基auristatin E, MMAE (IC50 ~ 10−10 M),但是,高活性的Payloads限制了药物的使用剂量。而DS-8201的成功,使得药物的开发转向了活性较低的拓扑异构酶I抑制剂类Payloads;优于早些年微管抑制剂的ADC药物比较成功,因此目前临床中的微管抑制剂类ADC药物占据优势。其次为DNA损伤剂类型的ADC,之后为TOPO-Ⅰ抑制剂类型的ADC。当然,除了传统的Payloads,还有一些靶向性小分子Payloads,如Bcl-xL抑制剂,TLR 和STING等免疫调节剂,但是这类ADC的开发目前还没有获得成功。
4、对未来 ADC 药物设计的影响
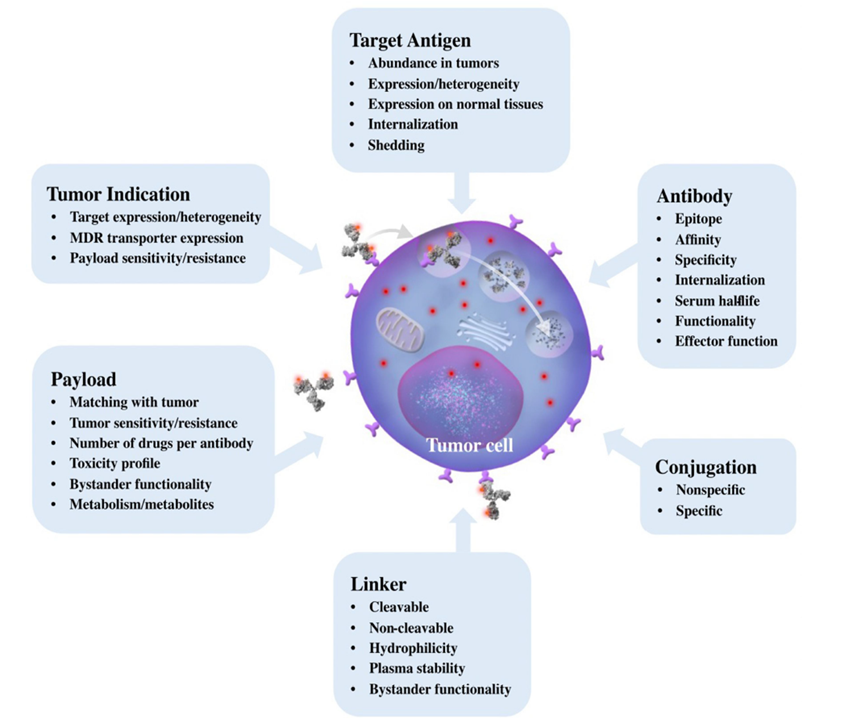
ADC本质是抗体药物和小分子药物的组合,其是利用抗体药物的特异性靶向将小分子药物递送到肿瘤细胞中,从而利用小分子药物抑制甚至杀伤肿瘤。其性质决定这类药物的开发需要考量很多因素。在药物端,需要考虑抗体的表位,特异性,亲和力,内吞,半衰期,抗体Fc介导的效应功能等;同时需要考虑payload的性质如毒性,旁观者效应,代谢,作用机制;另外,需要考虑linker对ADC药物物理化学性质及作用机制的影响。而在肿瘤端,需要考虑靶点的表达,靶点表达的异质性,对药物的耐受性等。
具有提高治疗指数潜力的下一代 ADC 的开发可以分为 ADC 的三个主要组成部分(抗体、连接体、有效负载)以及用于将抗体连接到有效负载的缀合技术。 此外,还需要考虑将适当的有效负载与给定的肿瘤适应症相匹配,同时注意肿瘤靶向生物制剂的癌症抗原密度。
(1)、生物技术的改进
抗体设计的改进包括结合剂选择和工程化,以:1) 选择促进最大内化的表位/亲和力,2) 优化/降低结合剂对正常组织上表达较高的靶标的亲和力,以及 3) 微调网络 ADC 负责减轻与目标无关的毒性。
靶向促进受体介导快速内化的表位的生物制剂比靶向非内化抗原表位的生物制剂显示出更大的活性。 引文 12 此外,据报道,双互补位和双特异性 ADC 生物制剂可改善 ADC 内化,从而提高 ADC 在靶抗原密度较低的肿瘤中的有效性。 Citation119、Citation120 目前正在测试的双互补位和双特异性 ADC 包括 REGN5093-M114 (c-MET、c-MET)、zanidatamab zovodotin (HER2、HER2)、IMGN151 (FRα FRα)、BL-B01D1 (EGFR、HER3)、M1231 (EGFR) 、MUC1) 和 ORM-5029 (HER2、HER3)。
除了选择内化表位和/或双互补位/双特异性抗原靶向之外,还需要针对所选抗原定制 ADC 生物制剂的生物亲和力优化。 事实上,亲和力较低的生物制剂可能在较低的靶抗原密度下表现出不充分的结合和/或内化。Citation13 和细胞亲和力过高的生物制剂可能会导致受体占用和/或内化减少。Citation14 生物亲和力调节也可能有助于减轻靶点/脱靶的影响。 肿瘤对正常组织中表达的抗原的毒性。 亲和力失调已被证明可以降低正常组织中的靶标依赖性毒性,同时保持对具有较高靶抗原表达的肿瘤细胞的活性。Citation13、Citation121
最后,优化 ADC 的净电荷已被证明可以减轻与目标无关的毒性。 例如,通过将单个 Lys 突变为 Asp 突变引入 ADC 生物制剂 AGS-16C3F,可降低眼部毒性。引文 122 这些结果表明,在 ADC 上产生净负表面电荷可以抑制与靶点无关的毒性 。
(2)、对连接体的改进
连接体不仅仅是抗体和有效负载之间的惰性桥梁; 它们影响给定 ADC 的稳定性和 PK。 一些早期 ADC(如 CMB-401)的性能不佳归因于不稳定的连接体。Citation102 ADC 连接体的改进已被证明可以减少系统有效负载释放并改善 PK 特性。 沿着这些思路,连接体开发的改进可能包括 1) 有效负载掩蔽连接体,2) 亲水性连接体,3) 用于增加药物负载的分支连接体,4) 串联裂解连接体,以及 5) 双裂解特异性连接体。
修饰接头以掩盖疏水性有效负载可以提高治疗指数。Citation123 一般来说,降低 ADC 的疏水性可以改善 PK 和治疗活性,Citation23 至少部分归因于微胞饮作用诱导的脱靶毒性的减少。Citation124 事实上,结合亲水性 ADC 中的大环化合物可掩盖疏水性有效负载,从而提高了 AdcetrisTM 类 ADC 的体内活性。Citation125
修改连接子以增加药物负载是提高包含低效有效负载的 ADC 有效性的另一种策略。 创建具有较高 DAR 负载的传统细胞毒性 ADC 的一个挑战是,由于疏水性有效负载数量的增加,ADC 分子的疏水性增加,这既增加了聚集的可能性Citation126,又加速了 ADC 从生物体中的清除。Citation16、Citation23 创建聚合物接头, 例如 FleximerTM 连接器 Citation127 或 PEG 链添加,无论是在抗体和连接器之间还是从传统连接器内的某个位置分支,Citation23 都可以增加 ADC 分子上的药物负载,而不会产生生物降解和/或清除的相关责任。 使用此类方法,可以在不增加 ADC 整体疏水性的情况下增加 DAR。 此外,由亲水性中性或带负电氨基酸(Ala、Gly、Pro、Ser、Thr、Glu;基于 XTENTM 肽的平台)的伪重复模式组成的多肽可以产生 DAR 高达 18 的 ADC,而不会影响 PK。 引文 128 增加接头亲水性可以通过减少 MDR1 泵对有效负载代谢物的排出来调节旁观者效应,从而改变 ADC 的毒性特征。引文 129 然而,这种方法可能不适用于所有 ADC。引文 130
最后,修饰可裂解接头以最大程度地减少全身释放,同时仍保持肿瘤旁观者效应,可以提高后续 ADC 分子的治疗指数。 需要通过仅在溶酶体内发现的酶连续裂解的工程连接体才能实现这一特性。 描述了一个葡萄糖醛酸酶可切割接头的例子,当切割时,会发现组织蛋白酶切割位点,从而实现有效负载释放——确保两个切割步骤仅发生在溶酶体内部。引文 131 人们发现,这种串联切割接头可以提高稳定性和稳定性。 ADC 在大鼠毒性模型中的耐受性。Citation131
(3)、有效载荷的改进
对有效负载的修改可以提高后续 ADC 的治疗效果,包括创建 1) 基于前药的有效负载以减轻肿瘤外毒性,2) 创建亲水性细胞毒性有效负载,以及 3) 创建双功能有效负载以增加 肿瘤疗效。 前药有效负载利用酸性、低氧、高唾液酸化和富含蛋白酶的 TME 来触发肿瘤中的活性有效负载释放。Citation132 前药可能涉及通过“加帽”来掩盖有毒、疏水性有效负载,例如 PBD。 前药帽设计为由 TME 酶(例如 β-葡萄糖醛酸酶)裂解,以最大程度地减少肿瘤外有效负载释放。引文 133 识别用于有效负载释放的其他内体运输调节剂和溶酶体途径调节剂可能有助于下一代的设计 前药有效负载。
(4)、有效负载结合的改进
有效负载的特定位点附件产生具有受控和定义的 DAR 的 ADC 制剂。 第一种通过半胱氨酸工程生产此类 ADC 的方法提供了均质制剂,与随机缀合的 ADC 相比,表现出优异的临床前 PK 特性和安全性。 引文 18 这些发现引发了该领域的热情,并导致了针对位点特异性缀合的其他方法的开发 。 迄今为止,位点选择性缀合方法分为八类:半胱氨酸工程、非天然氨基酸工程、与天然半胱氨酸的缀合、肽标签、聚糖修饰、酶促修饰、二硫键重桥以及与天然赖氨酸的缀合。Citation140 未使用任何方法 迄今为止,位点特异性缀合已被证明对 FcRn 回收有直接影响,可以改变 ADC PK、功效和安全性。
目前正在探索通过非天然氨基酸方法进行连接子-有效负载缀合。 然而,人们注意到,尽管稳定性和 PK 相当,但连接子-有效负载附着的非天然氨基酸缀合位置对肿瘤杀伤产生了显着影响。Citation141
使用肽标签技术进行位点特异性缀合的例子有 SMARTagTM 和谷氨酰胺标签。 SMARTagTM 通过使用将接头有效负载附加到甲酰甘氨酸的醛标签来实现位点特异性缀合。Citation142 谷氨酰胺标签技术利用转谷氨酰胺酶来附加接头有效负载。Citation143 这两种技术都被证明可以提高 PK 和功效。Citation142、Citation143
GlycoConnectTM 是位点特异性聚糖修饰缀合方法的一个示例。 此处,在天冬酰胺-297 位点对抗体进行聚糖重构后,通过连接接头有效负载来实现位点特异性缀合。引文 144 然而,由于天冬酰胺-297 聚糖对于抗体 Fcγ 受体效应器功能很重要,因此该方法需要 与 Fc 效应器功能的损失相平衡,否则可以为开发的 ADC 提供功效益处。引文 145
位点特异性技术的一个显着进步是 AJICAPTM 方法,该方法利用天然赖氨酸进行位点特异性链接子有效负载连接。 该方法不需要抗体工程或酶促反应。 由此产生的 ADC 在临床前模型中显示出改善的治疗指数。引文 17
临床上,与非特异性半胱氨酸偶联的对应物索菲珠单抗 vedotin (MUC16) 相比,位点特异性 ADC DMUC4064A (MUC16) 可以以更高的生物剂量施用,具有更高的总体响应率。Citation52 虽然前景光明,但位点特异性有效负载偶联并不总是有效 在治疗改善方面。 例如,与非特异性半胱氨酸缀合 ADC PolivyTMCitation60 和 rovalpituzumab tesirine 相比,位点特异性缀合 ADC iladatuzumab vedotin (CD79b) 和 SC-002 (DLL3) 并未表现出临床反应/治疗指数的改善
5、小结
在针对肿瘤适应症进行测试的 267 种 ADC 中,有 11 种已获得 FDA 批准; 92已停产。 对已停产候选药物相关局限性的分析有助于为下一系列分子的设计和选择提供信息。 重要的是,新的生物工程修饰已在临床前被证明可以提高治疗指数。 采用综合、多因素的方法,仔细选择目标,同时优化抗体、接头和有效负载(与感兴趣的适应症相匹配)将有望迎来下一波新的 ADC 批准。
参考文献
Heather Maecker, Vidya Jonnalagadda, Sunil Bhakta et al. Exploration of the antibody–drug conjugate clinical landscape. Mabs 2023


