【文献】黄瘤巨细胞形态的肾细胞癌是TSC相关肾细胞癌的另一种形态
时间:2023-09-04 11:56:39 热度:37.1℃ 作者:网络
本文章报告2例具有TSC/mTOR突变但不同与以上三种亚型的肾细胞癌,且不适合任何先前描述的实体。这2例肾癌均发生于年轻患者(年龄分别为10岁和31岁),两名患者都没有结节性硬化症的临床或病理特征。镜下均显示肾内浸润性生长,并出现肾周淋巴结转移及脉管侵犯。肿瘤细胞失粘附,实性生长,主要以大的、胞浆丰富、嗜酸性细胞为主,一些细胞显示胞质内空泡,常伴有多核巨细胞,核圆形,呈泡状,核仁显著,但有丝分裂象罕见,Ki-67指数较低(<1%)。一名患者在肾切除术未进行辅助治疗后的7年随访中,均显示无病生存,提示该肿瘤仍然具有较好预后。
病例
病例1
10岁男性,以血尿为表现,发现有一个10.5cm的肾肿块。无TSC的临床或病理特征。
大体:非常易碎且界限不清。大体描述可见明显坏死,但在显微镜下只有局灶性与出血相关的坏死。
治疗:根治性肾切除,未接受任何辅助治疗。
随访:术后7年无疾病。
镜下改变(如下)
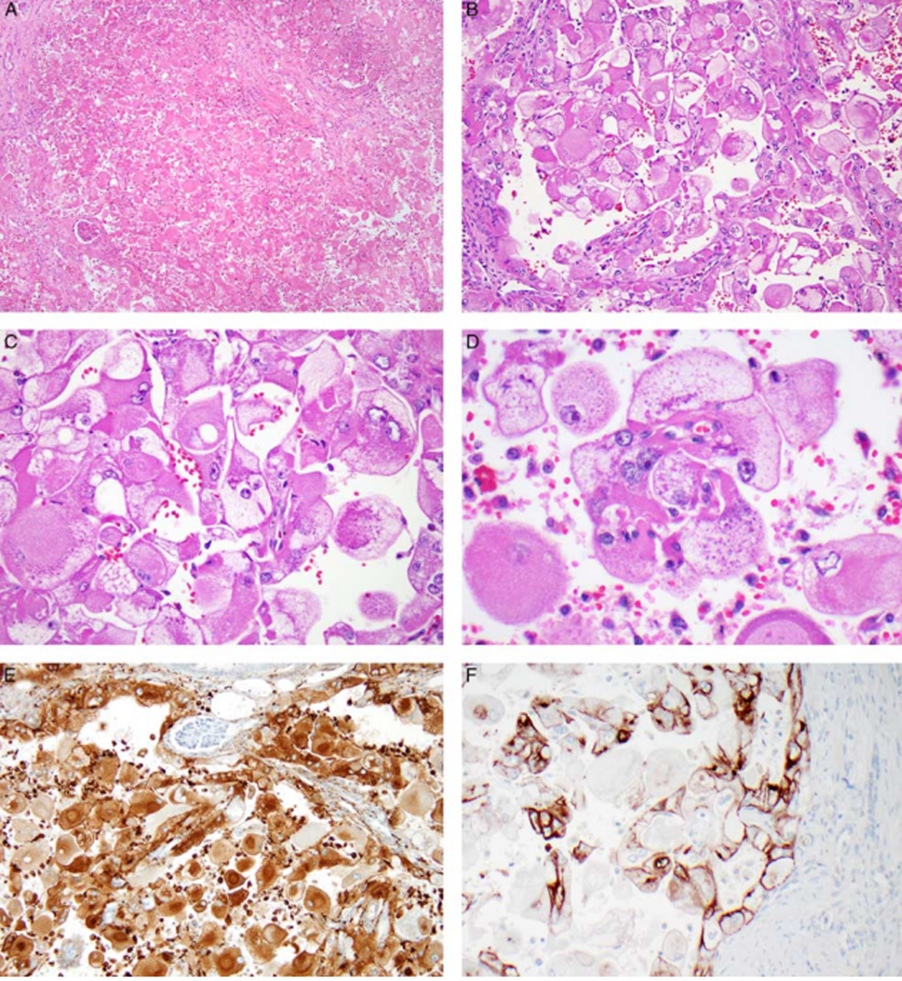
图A:肿瘤呈片状浸润性生长;左侧可见肾小球;
图B:肿瘤主要由分散的瘤巨细胞组成,局灶可见囊性腔隙形成栅栏状结构,提示上皮性肿瘤的可能性;
图C:显著细胞质内空泡;
图D:细胞质内嗜碱性点状颗粒;
图E:cathepsin K(弥漫性+);
图F:CK20(+)。
其他:Cam5.2(50%肿瘤细胞+)、vimentin(+)、CD10(+)、CD68(+)、CD163(-)、PAX8(弱+/-)、EMA(-)、pan-CK(极少数+)、HMB45/Melan A/MITF/SF-1/TFE3(-),Ki-67(<1%);核分裂象少见。肾内血管侵犯;肾周淋巴结显示转移。
病例2
31岁女性,终末期肾病,正在透析,继发于病因不明的血栓性微血管病,因胸痛进行放射学检查时偶然发现有一个4cm的肾肿块。
大体:非常易碎且界限不清。大体描述可见明显坏死,但在显微镜下只有局灶性与出血相关的坏死。
随访:该病例发生时间太近,无法进行有意义的后续随访。
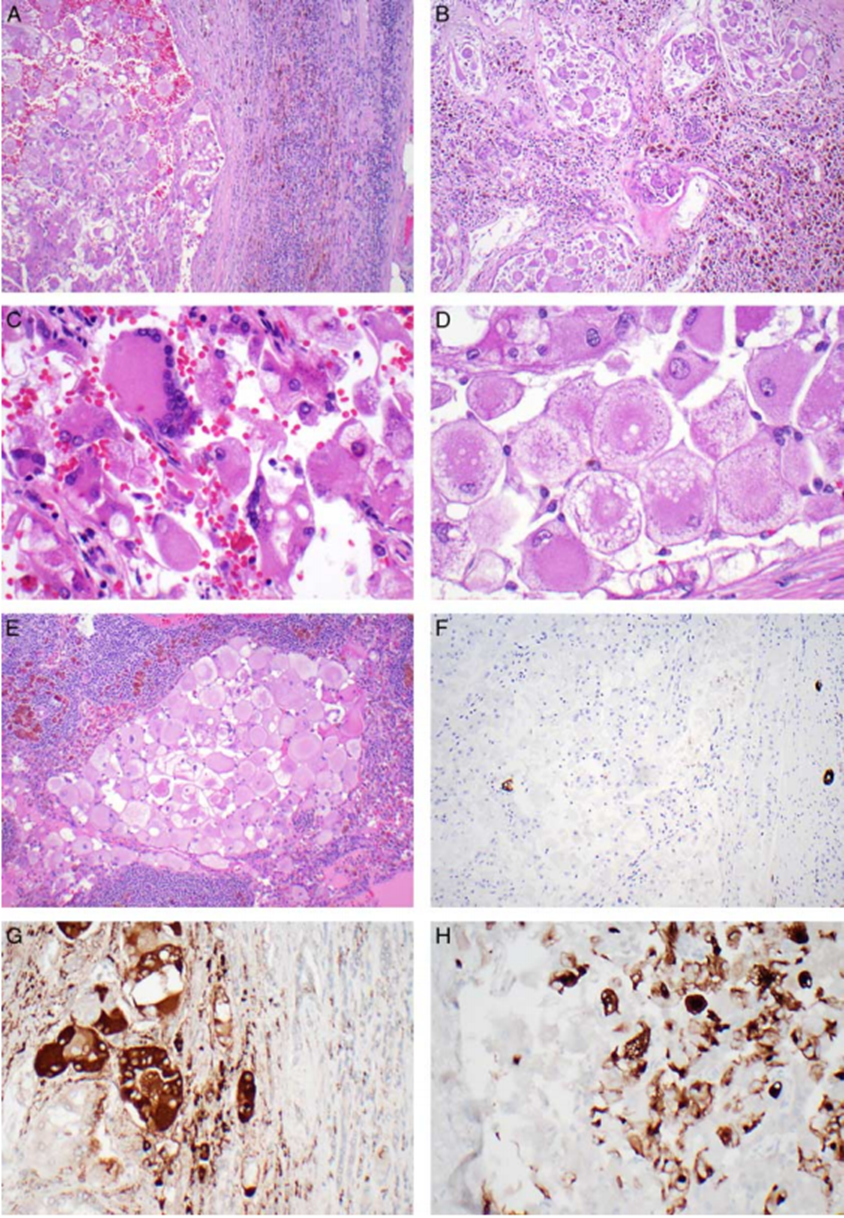
图A:肿瘤(左)与右侧肾相邻;
图B:肾内浸润性生长;
图C:肿瘤细胞明显增大,细胞质黄瘤性和空泡化;
图D:细胞质嗜碱性斑点,与黄色瘤样改变相关;
图E:淋巴结转移;
图F:pan-CK反应极少;
图G:cathepsin K(+);
图H:CK20(约50%的肿瘤细胞+)。
其他:CK8(极少数+)、vimentin(+)、CD10(+)、CD68(+)、CD163(-)、PAX8(弱+/-)、EMA(-),Ki-67(<1%);核分裂象少见。肾内血管侵犯;肾周淋巴结显示转移。
对比
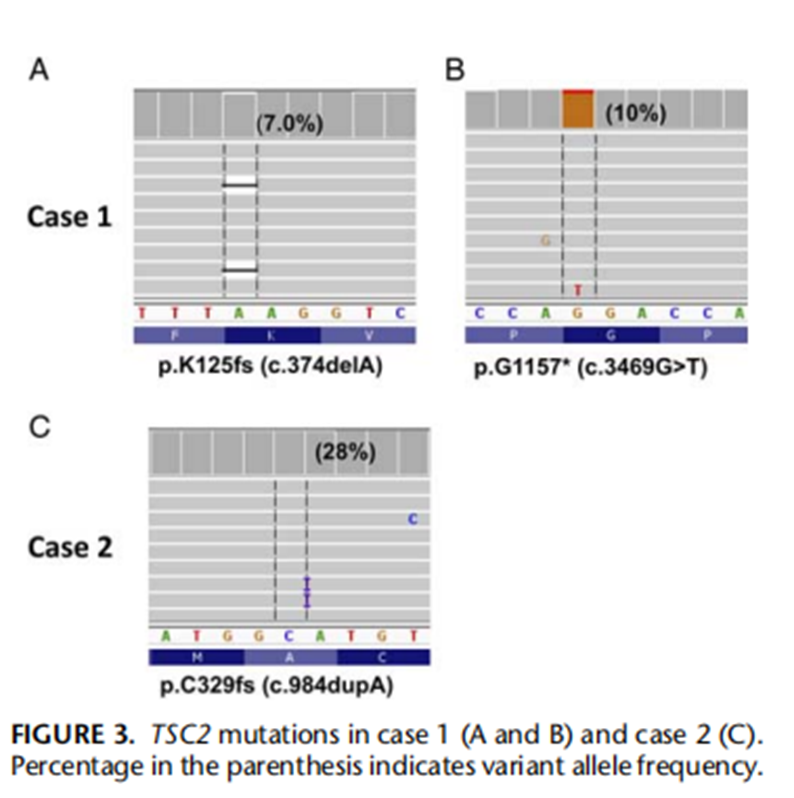
NGS检测到2例肿瘤TSC2基因突变(Figure3)。
病例1(A和B)显示移码突变(p.K125fs)和无义突变(p.G1157*)。
病例2(C)显示移码突变(p.C329fs)。没有检测到额外的驱动突变。
注:等位基因低变异频率提示体细胞突变而不是种系突变。
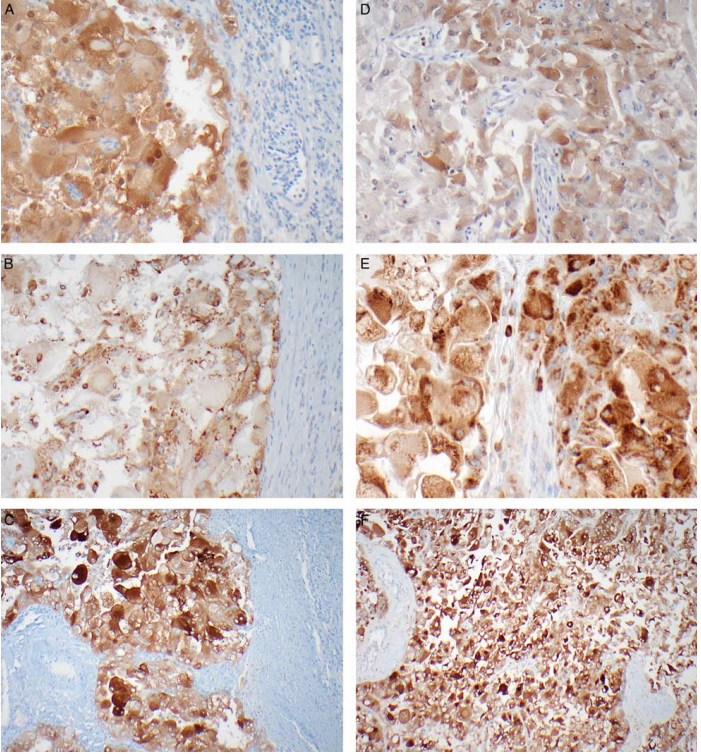
病例1 pEBP1(70%的肿瘤细胞+)(A);pS6(>50%肿瘤细胞+)(B);GPNMB(弥漫+)(C)
病例2 pEBP1(20%的肿瘤细胞中度+)(D);pS6(>50%肿瘤细胞强+)(E);GPNMB(强+)(F)
注:GPNMB表示糖蛋白非转移性黑色素瘤蛋白B
免疫组化显示了mTOR通路激活的证据,支持TSC2突变是mTOR相关肿瘤的驱动因素。
讨论
结节性硬化症(Tuberous sclerosis,TSC)
结节性硬化症是一种多系统受累的常染色体显性综合征。患病率高达1/6000。没有性别或种族偏好,但部分症状存在性别差异。TSC涉及到的器官遍及全身,主要包括大脑(如癫痫、皮质结节、室管膜下结节和巨细胞星形细胞瘤)、皮肤(低黑色素斑块、面部血管纤维瘤、皮脂腺瘤)、肾脏(多发性肾囊肿)、心脏(心脏横纹肌瘤)、眼睛、肺(肺淋巴管肌瘤病)、骨骼等。TSC 显示出几乎完全的外显率,具有很强的表型异质性。任何携带TSC的突变都可能会受到疾病的影响,只是表现程度不同。1/3的TSC病例是遗传所致,2/3是由于人类胚胎在受孕或早期发育过程中的自发突变所致。
已鉴定出两个可导致TSC的基因
分别是TSC1基因和TSC2基因,其中任一基因的变异都会导致TSC的发生。此外,由于在同一细胞内途径中共同作用,所以两个不同基因的突变都会引起同样的疾病。TSC1 基因位于第9号染色体上,编码hamartin蛋白;TSC2基因位于16号染色体上,编码tuberin蛋白。TSC1基因突变大多是无义或移码突变,约 10-20%患者发生TSC1基因突变。TSC2基因突变大多是错义突变、大缺失或重排,约 70-90%患者发生TSC2基因突变。由于体细胞嵌合或内含子或启动子区域突变等原因,10-25% 的遗传病例的基因检测可能呈阴性。Hamartin 和tuberin与蛋白质TBC1D7 结合,形成 TSC 蛋白质复合物,该复合物充当大脑中的 RAS 同源物 (Rheb) 的 GTPase 激活蛋白。在正常情况下,TSC 复合物的功能是使Rheb处于非活跃的 GDP 绑定状态,从而使其无法刺激 mTORC1。当TSC1 或 TSC2 发生突变时时,由于TSC 复合物无法正常合成,导致对 Rheb 的制动被释放,mTORC1 被 Rheb 激活。mTOR信号通路激活刺激S6 激酶的同时,抑制4EBP1,导致无限制的蛋白质合成和增殖。
鉴别诊断
1、ESC RCC
肿瘤细胞胞质丰富嗜酸、多核瘤巨细胞、细胞质内的大空泡及嗜碱性斑点这些形态特点亦可以见于ESC RCC,且CK20阳性是ESC RCC的特征性免疫表型,TSC 基因突变与ESC RCC相似。但是细胞质内的大空泡仅见于少数ESC RCC中且表现为局灶性。此外,多核瘤巨细胞在ESC RCC中通常是局部性的,并与囊肿有关。高度浸润性的生长模式和散在性的巨细胞黄色瘤形态超出了ESC RCC的典型形态范围,典型的ESC RCC表现为界限清晰,通常由黏附性好的上皮样肿瘤细胞组成。综上,推测这两例肿瘤与ESC RCC密切相关,但不同于典型的ESC RCC。
2、EVT/LOT
明显空泡化是EVT的特征之一,LOT镜下表现为低级别核特征,无胞质空泡性改变,且二者一般肿瘤直径小,边界清楚,肿瘤不呈现浸润性生长方式以及脉管和淋巴结的侵犯。免疫组化CK20表达不支持EVT/LOT。
3、获得性囊性肾病相关肾细胞癌
病例2患者具有长期透析肾病史,需要排除获得性囊性肾病相关肾细胞癌。后者镜下常可见草酸盐结晶,肿瘤细胞呈腺管排列和明显的胞质空泡使肿瘤低倍镜呈筛状结构,CK7及其他上皮标记阳性,CK20阴性可加以鉴别。
4、TFE3/TFEB重排肾细胞癌
文章两例均未发现TFE3基因重排。病例1免疫组化TFEB阴性,病例2分离荧光原位杂交TFEB重排或扩增阴性。结合形态、组化、分子加以鉴别。
5、组织细胞肿瘤
黄色瘤样巨细胞形态,不同于一般的肾细胞癌,且肿瘤细胞表达CD68和cathepsin K等组织细胞标志物,EMA、pan-CK上皮性标记表达阴性,极有可能被误认为是组织细胞肿瘤。但是庆幸的是更特异的组织细胞标记CD163阴性、CK20上皮标记阳性否定了组织细胞肿瘤的可能性。
CK20应该纳入TSC相关性嗜酸性肾肿瘤常规套餐中
文章中报道的两例肾细胞癌,肿瘤细胞体积大,肿瘤细胞表达CD68和cathepsin K等组织细胞标志物,EMA、pan-CK上皮性标记表达阴性,Cam5.2以及CK8这样的低分子量细胞角蛋白仅呈现局灶性反应,且PAX8阴性或者不确定的阳性,极有可能被误认为是组织细胞肿瘤而不是癌的诊断。但是CK20作为一种低分子量细胞角蛋白,通常不用于筛选上皮分化,在这些病例中显示出最令人信服的表达结果,有助于做出癌的诊断以及考虑到TSC 基因相关肾肿瘤。所以CK20应该纳入TSC 基因相关肾肿瘤常规套餐中。
关于TSC 相关性嗜酸性肾肿瘤的新的形态线索
本文推测细胞大小的增加(瘤巨细胞形态),虽然不是特异性的,但可能是该类肿瘤的形态学线索之一。因为mTOR通路的激活与体外细胞大小和细胞生长的增加有关。例如其他结节性硬化症相关肿瘤,如室管膜下巨细胞星形细胞瘤和上皮样血管平滑肌脂肪瘤常以瘤巨细胞为特征。
TSC相关性嗜酸性肾肿瘤的预后
以往的三种 TSC相关性嗜酸性肾肿瘤:嗜酸性实性囊性肾细胞癌(ESC-RCC),嗜酸性空泡状肿瘤(EVT),以及低级别嗜酸性肿瘤(LOT)具有较惰性的生物学行为。本文报告两种不同的TSC2突变肾细胞癌,不适合任何先前描述的实体。虽然肿瘤在肾内高度浸润性生长,并出现肾周淋巴结转移及脉管侵犯,表现出恶性的组织形态和生长模式,但有丝分裂象罕见,Ki-67指数较低(<1%)。一名随访患者仅在肾切除术后未进行辅助治疗后7年的随访中,未显示疾病迹象,提示该肿瘤仍然具有较好预后。


