癌症靶向治疗的圣杯:卢敏团队首次在人体内实现p53靶向
时间:2023-04-12 10:00:32 热度:37.1℃ 作者:网络
抑癌蛋白(Tumor suppressor)是阻止癌症发生的“分子警察”,而促癌蛋白(Oncoprotein)是引起癌症发生的“分子流氓”。癌症发生的主要原因是警察受伤,亦即抑癌蛋白发生突变,导致其功能减弱;其次是流氓学会武术,亦即促癌蛋白发生突变,导致其功能增强(下图1,一半以上癌症驱动突变发生于抑癌蛋白)。
然而目前临床获批的所有约80个小分子靶向药物都通过消灭会武术的流氓来治疗癌症,亦即现有靶向药物只能靶向促癌蛋白;还没有一个药物可以通过拯救受伤的警察来治疗癌症,亦即现有靶向药物无一能够抑癌蛋白,这在很大程度上造成了临床上只有2-13%的癌症患者有靶向药物可用的窘境。
靶向抑癌蛋白需反现有靶向策略其道而行——恢复而非抑制蛋白功能。蛋白功能抑制策略(主要是用小分子竞争性占据蛋白活性位点,进而抑制蛋白功能)具高度逻辑性,催生了大量癌蛋白抑制剂;蛋白功能恢复策略(用小分子结合蛋白并恢复其功能)却缺乏理论基础和逻辑支撑,至今尚未建立。亦即,科学家利用逻辑明确、较为普适的蛋白功能抑制策略,实现了很多癌蛋白的靶向,但关于如何靶向抑癌蛋白却无从下手(下图1)。
以抑癌蛋白p53为例,它是癌症中突变频率最高的蛋白,在约50%癌症患者体内发生突变,该突变频率遥遥领先任何其余任何蛋白【1】;p53是历史上以及目前被研究最多的蛋白,该研究热度遥遥领先其余任何蛋白【2】;过去20年来,至少有50-70个团队在高水平期刊上发表可以靶向p53突变的各种各样的药物,但领域小同行众所周知:已报道的p53突变体功能恢复小分子化合物(简称恢复剂,如APR246等共有几十个)缺乏独立验证、其p53功能恢复效果难以被检测到【3】。
基于以上现状,p53恢复剂被至少14篇不同的文献称为是癌症靶向治疗领域的圣杯。如能获得该圣杯,将在科学将上开启抑癌蛋白这一最广泛发生突变却迄今不可成药的靶点,在临床上大幅增加靶向治疗的受益人群(下图1)。
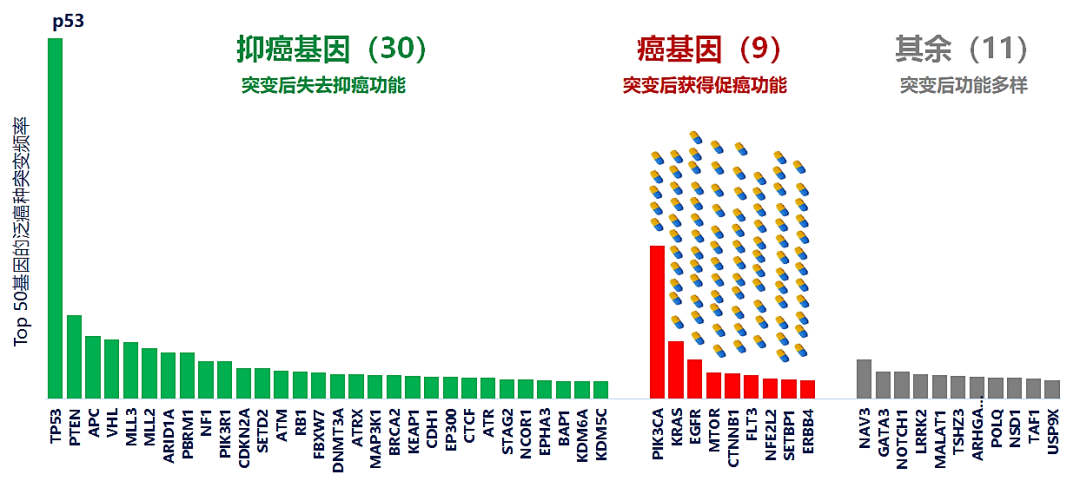
图1:泛癌种中最高频发生突变的50个基因。药丸表示获批的靶向抗癌小分子。基因突变频率的突变数据来自Nature, 2013. 502(7471): 333-9;基因分类源自OncoKB。
上海交通大学医学院附属瑞金医院卢敏团队前期从“癌症中有上千种不同的p53突变体,不同突变体失去抑癌功能的机制各不相同,可以分成不能折叠的结构型突变体、DNA结合氨基酸发生突变的DNA结合型突变体、无意突变体等等各种各样的突变体,因此不可成存在可以恢复所有不同类型p53突变体功能的恢复剂”这一逻辑性假设出发,于2021年提出“胶连p53多个半胱氨酸以促进结构型p53突变体重新折叠”的功能恢复策略,据此获得结构型p53突变体功能恢复剂三氧化二砷ATO(Arsenic Trioxide,后获得多个不含砷p53恢复剂如PAT),并揭示其稳定p53三级结构的促折叠机制【4】。
和已报道的各种p53恢复剂相比:ATO恢复p53突变体功能的效果被广泛重复、p53功能恢复的结构学机制明确、和结构学机制相一致地只能恢复结构型p53突变体的功能、临床试验中被用于治疗携带可以被ATO恢复功能的结构型p53突变体的癌症患者;而其余已报道的20余个广谱性p53恢复剂(注:PhiKan083、PC14586等恢复剂只靶向p53-Y220C单个突变体,不在本文讨论范围)不能被检测到p53功能恢复效果、缺乏结构学机制、论文发表后从未被系统性研究哪些p53突变体可以被其恢复功能、临床试验中被用于治疗携带任意p53突变体的癌症患者(下图2)。
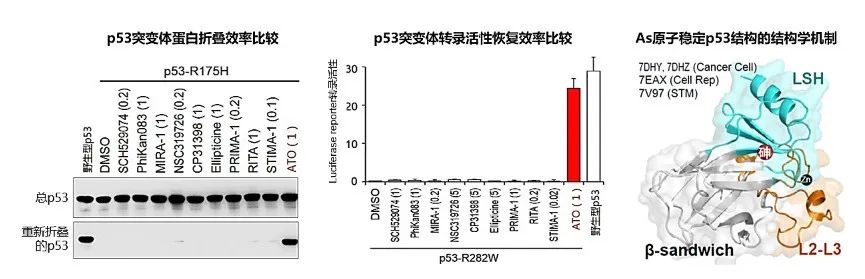
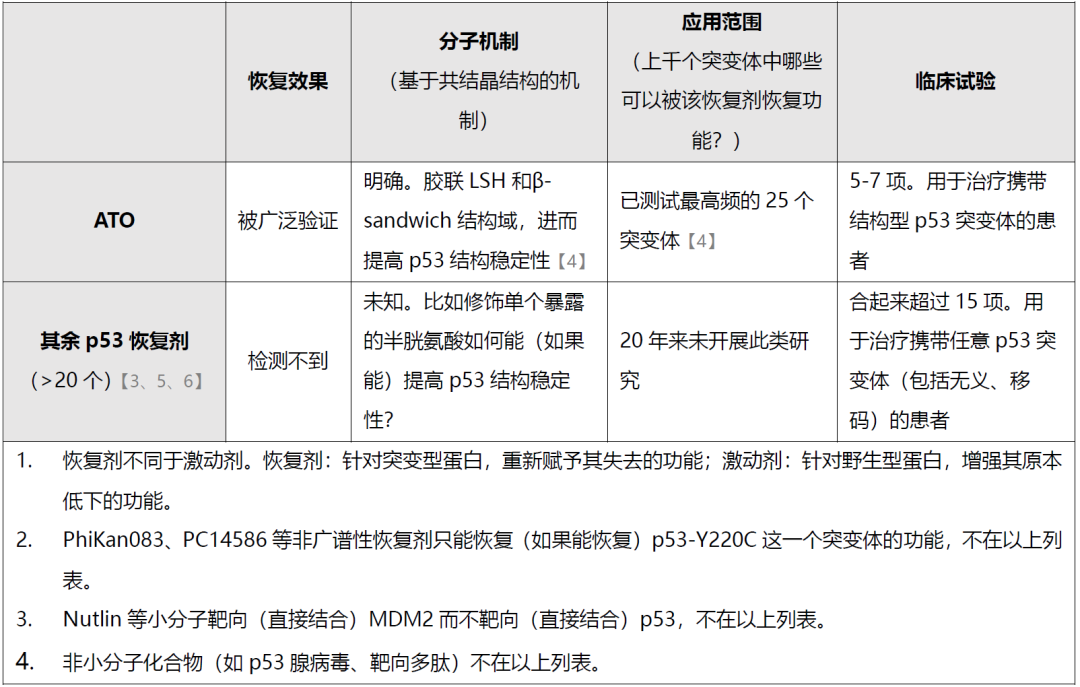
图2:(左、中)在代表性p53恢复剂的测定中,ATO高效恢复p53突变体蛋白折叠(蛋白折叠出三级结构才能发挥功能)和转录活性(转录调控是p53发挥抑癌功能的主要机制);(右)ATO释放砷原子并在p53内部胶联LSH和β-sandwich结构域,进而提高p53结构稳定性。(下表)现有p53恢复剂研究头对头比较。
然而,目前只有大概10来个常见的p53突变体被研究过其是否是结构型突变体,因此上千个p53突变体中哪些可以被三氧化二砷(ATO)恢复功能还未知;此外ATO临床治疗中具有毒副作用,其安全剂量浓度在人体内是否足以恢复p53突变体的功能还未知。
近日,上海交通大学医学院附属瑞金医院卢敏团队在 Science Translational Medicine 期刊发表了题为:Diverse rescue potencies of p53 mutations to ATO are predetermined by intrinsic mutational properties 的研究论文。

该研究:
1)测定了ATO对800个癌症中最常见的p53突变体的功能恢复效率,鉴定并公开了390个可以被ATO恢复功能进而用于临床治疗的p53突变体(www.rescuep53.net);
2)据此提出基于每一个单独p53突变体的功能恢复效率来进行治疗的高度精准治疗理论,并利用该理论首次在人体内(first-in-human)实现p53功能恢复,并减少白血病患者的微小病灶残留。
研究通过生化实验、细胞试验、小鼠实验,系统性鉴定出390个可以被ATO不同程度地恢复功能的p53结构型突变体。关键的是,这些结构型突变体被ATO恢复功能的效率差异巨大,其本质原因是:折叠状态下温敏性高的结构型突变体如V272M和M133T,其DNA结合面和野生型一致,因此这类突变体被药物诱导重新折叠后可以重新结合DNA并高效恢复功能;而折叠转态下温敏性低的结构型突变体如R249S则组装出大幅扭曲的DNA结合面,因此这类突变体被药物诱导重新折叠后不能结合DNA故不能被恢复功能。V272E和M133R突变在p53内部导入大侧链氨基酸,使p53内部完全不兼容,蛋白极难重新折叠,因此难以被恢复功能;R175H和G245S是介于高温敏和无温敏之间的弱温敏突变体,它们重新折叠后DNA结合面仍有轻微扭曲,因此,其DNA结合能力和抑癌功能只能被部分恢复。

图3:即使是结构型p53突变体(甚至是同一个氨基酸发生不同突变的结构型突变体),其被同一个结构稳定剂恢复功能的效率也大不相同。功能恢复效率的底层决定因素是:p53能否在整体上重新折叠?重新折叠后能否在局部区域组装出野生型的DNA结合面?p53突变体温敏程度的决定因素是:p53重新折叠后DNA结合面的完整程度。
之后,研究根据(p53突变体在三个检测系统中)功能恢复效率的高低,把p53突变体分成三类:可以被完全恢复功能的type-1型突变体,有33个(图4左,示例前10个);可以被恢复较多功能的type-2a型和被恢复较少功能的2b型突变体,有357个;不能被ATO恢复功能的type-3型突变体,有410个。之后研究对ATO恢复这三类突变体抑癌功能的能力进行了验证。
对源自10个癌种的47株细胞系的体外细胞培养研究表明,ATO对 type-1型和type-2a型p53突变体具有更好的功能恢复效果,且不限癌种;对3个isogenic CDX小鼠模型、源自五个癌种的7个PDX“小鼠临床试验”(图4右)的研究均表明,ATO对携带type-1型和type-2a型p53突变体的小鼠肿瘤具有更好的治疗效果,且不限癌种。
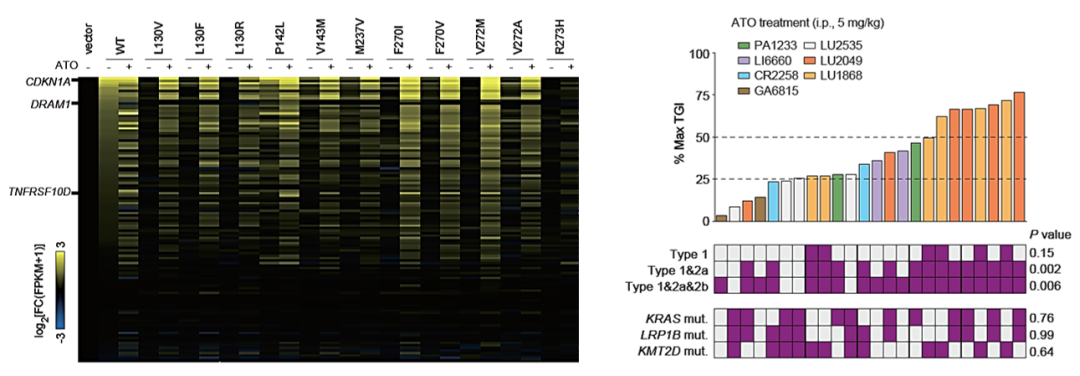
图4. (左)Isogenic细胞系的RNAseq表明,10个type-1 p53突变体经过ATO处理后,均可以高效上调p53靶基因,且对116个p53靶基因的转录选择性和野生型p53非常接近;type-3 p53突变体R273H则不能被ATO恢复功能。(右)在源自5个癌种的7个PDX的“小鼠临床试验”中,ATO的肿瘤增殖抑制能力(TGI)和type 1&2a型p53突变体的出现显着相关,与其余关键驱动基因的突变不相关。紫色方框代表发生该基因突变。
最后,研究提出基于每一个p53突变体功能恢复效率来入组患者的高度精准治疗策略。在一项临床试验中,研究发现一位携带type-1 p53突变体的白血病患者。标准剂量ATO单药治疗后,对患者体内单个核细胞进行单细胞测序,结果表明:
1)患者体内癌细胞中的经典p53靶基因如CDKN1A、BBC3/PUMA、GADD45A、MDM2等发生了与体外细胞培养体系研究中一样高效、特异地上调(图5左),这证实了p53抑癌功能所依赖的转录活性已被恢复;
2)血液样品中微小病灶残留MRD显着减少(图5右),其主要marker CD34、CD117、CD13、CD33、CD45的表达水平均发生显着、大幅下调。
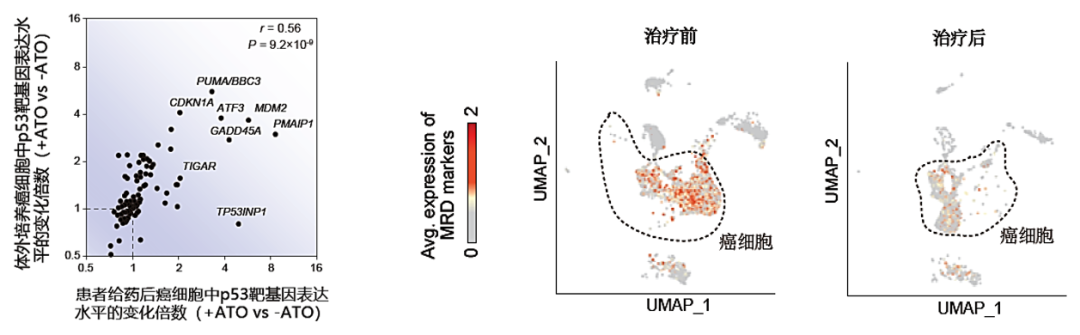
图5:(左)ATO治疗后患者体内癌细胞中p53靶基因的表达水平变化,与ATO处理的体外培养细胞的p53靶基因的表达水平变化趋势一致,其中可见经典p53靶基因都发生大幅上调。(右)患者治疗后微小病灶残留MRD的markers的表达水平整体上显着下调。
该研究潜在的学术价值是:在p53领域,首次在人体内(First-in-human)实现p53功能恢复;在靶向治疗领域,首次在人体内(First-in-human)实现抑癌蛋白靶向。这将有助于开拓人类癌症中突变最广泛但迄今无一成药的抑癌蛋白这一类靶点(见图1)。
该研究潜在的临床价值是:1)临床上目前获批约80个靶向抗癌药物,但这些靶向药物所针对基因的突变率都较低,导致了只有2-13%的癌症患者有靶向药物可用的临床现状。约50%的癌症人群携带p53突变,约30%的癌症人群携带结构型p53突变,因此p53靶向药物理论上具有广泛的适用人群。2)每年花费在p53突变癌症患者上的治疗费用超过870亿美元,相当于一个中小型国家的GDP,因此p53靶向药物理论上具有较高的临床价值。

卢敏研究员
卢敏,p53恢复剂获得者,在浙江大学、哈佛大学、牛津大学完成从本科到博士后的科研培训,之后入职上海交大瑞金医院,任研究员。长期从事p53单一蛋白研究,通过对p53长期的理解获得恢复剂ATO:2005年在研究p53分子进化时,发现p53内部第124、135、141位氨基酸在物种进化过程中疏水性逐渐降低、侧链逐渐变短、最终在人类中均进化成cysteine的奇怪现象;2021年意识到p53内124-135-141空间的空心化是造成p53结构脆性的一个重要原因,从二硫键胶连cysteine并稳定胰岛素高级结构这一现象中获得灵感,设计了用小分子胶连C124-C135-C141来恢复结构型p53突变体蛋白折叠和抑癌功能的策略。在开展具体药物筛选时,在认为不可能存在可以恢复所有p53突变体功能的全能恢复剂、准确地选择p53结构型突变体为研究对象、逻辑地以提高蛋白热稳定性(即提高Tm、提高结构稳定性、提高蛋白折叠效率)为筛药readout的基础上,同时在测试所有p53恢复剂和所有p53恢复剂评估assays并准确选择和优化这些评估assay的基础上(比如不采用被广泛使用的“基于p53结构表位的PAb1620抗体的免疫荧光染色assay”;采用室温而非4℃下进行的“利用PAb1620抗体特异性识别折叠的p53的免疫沉淀assay”),最终在一次偶然情况下发现ATO可以恢复p53突变体功能,据此揭示了ATO作为“分子内胶水”共价结合C124-C135-C141口袋并胶连p53 LSH和β-sandwich结构域以提高p53结构稳定性的结构学工作机制。这些研究发现在过去两年以最后通讯作者发表于 Cancer Cell(2021),Sci Transl Med(2023),Cell Rep(2022),STTT(2021),EMBO Rep(2022),JMCB(2021)等期刊。
p53恢复剂ATO的发现引出靶向治疗领域两个有趣的科学问题。在568个明确的癌症治疗靶点中【7】,~95%(539/568)治疗靶点尚未成药。细究成药的29个靶点,发现它们几乎全都是癌蛋白(其中22个是激酶),无一是抑癌蛋白。再细究针对这29个靶点的~80个靶向药物的研究历程,可以发现它们的成功往往得益于目标靶点有天然的口袋(内源性配体结合口袋)、有普适的作用机制(用小分子竞争性占据内源性配体结合口袋,即可实现蛋白功能抑制)。然而,ATO结合口袋的发现和ATO作为分子内胶水的作用机制很难推广到其余靶点,这引出了癌症靶向治疗领域两个有趣的科学问题:
1)绝大多数癌症治疗靶点缺乏小分子结合口袋,如何广谱性靶向这些“光滑”蛋白?
2)一半以上癌症治疗靶点是抑癌蛋白但不同抑癌蛋白突变后失去功能的机制各不相同,是否具有普适的抑癌蛋白功能恢复机制?
卢敏团队近年来与多学科团队合作,整合共价靶向、点击化学等,创造了可以在蛋白表面诱导新生口袋的HomoArt策略、可以广谱性靶向抑癌蛋白的TPF策略,在实验室水平已获得或将获得靶向p53、KRAS-G12D、PTEN、p16(CDKN2A)等重要靶点的新结构、新口袋、新机制靶向小分子。
参考文献:
1. Kandoth, C., et al., Mutational landscape and significance across 12 major cancer types. Nature, 2013. 502(7471): p. 333-9.
2. Dolgin, E., The most popular genes in the human genome. Nature, 2017. 551(7681): p. 427-431.
Sabapathy, K. and D.P. Lane, Therapeutic targeting of p53: all mutants are equal, but some mutants are more equal than others.Nat Rev Clin Oncol, 2018. 15(1): p. 13-30.
3. Chen, S., et al., Arsenic Trioxide Rescues Structural p53 Mutations through a Cryptic Allosteric Site. Cancer Cell, 2021. 39(2): p. 225-239 e8.
4. Hassin, O. and M. Oren, Drugging p53 in cancer: one protein, many targets. Nat Rev Drug Discov, 2022: p. 1-18.
5. Wang, H., et al., Targeting p53 pathways: mechanisms, structures, and advances in therapy. Signal Transduct Target Ther, 2023. 8(1): p. 92.
6. Martinez-Jimenez, F., et al., A compendium of mutational cancer driver genes. Nat Rev Cancer, 2020. 20(10): p. 555-572.


