【论著】| 涎腺玻璃样变透明细胞癌8例临床病理学特征分析
时间:2023-08-16 11:44:46 热度:37.1℃ 作者:网络
[摘要] 背景与目的:涎腺玻璃样变透明细胞癌(hyalinizing clear cell carcinoma,HCCC)是好发于小涎腺的少见肿瘤,生物学低度恶性。由于罕见,该肿瘤不为病理科医师所熟知,误诊时有发生。本研究旨在探讨涎腺HCCC的组织学形态、免疫表型及分子病理学特点。方法:收集复旦大学附属肿瘤医院病理科2015年1月—2019年10月确诊的涎腺HCCC 8例,分析其临床、病理学特点,并采用荧光原位杂交的方法检测肿瘤组织中EWSR1基因相关易位情况,总结诊断及鉴别诊断要点,并结合文献复习进行分析。结果:患者均为女性,年龄26~68岁,肿瘤发生于口腔、鼻咽、腮腺及头颈部区域其他部位。显微镜下主要由透明细胞和嗜酸性细胞以不同比例混合而成,形成巢团状、片状、梁索状结构。1例肿瘤几乎完全由嗜酸性细胞构成,6例可见明显的细胞核内假包涵体,1例肿瘤组织与表面黏膜鳞状上皮相连,1例肿瘤部分区域可见腺管样结构,3例肿瘤癌巢周围形成淋巴细胞套,7例具有硬化性或玻璃样变性的间质,亦或出现促纤维结缔组织反应性间质,1例间质伴有黏液变性。所有肿瘤均未见明确角化、坏死,核分裂象罕见。免疫组织化学检测结果显示,8例肿瘤弥漫表达AE1/AE3,7例表达P63,7例肿瘤细胞灶性表达低分子角蛋白CK7或CAM5.2,但S-100、calponin、PAX-8、CD10均呈阴性,所有肿瘤增殖活性较低,Ki-67增殖指数均小于5%。荧光原位杂交检测显示,8例均有EWSRl基因相关易位。随访4~50个月,所有患者均无复发或转移。结论:涎腺HCCC是好发于小涎腺的低度恶性肿瘤,其形态学特征明显,但需与其他多种原发或继发性涎腺肿瘤鉴别。多数患者预后良好。
[关键词]涎腺肿瘤;玻璃样变透明细胞癌;临床病理学特征
[Abstract]Background and purpose: Hyalinizing clear cell carcinoma (HCCC) of salivary gland is a rare tumor with low-grade malignancy, which usually occurs in minor salivary glands. Due to its rarity, the tumor type is not well known to pathologists and misdiagnosis frequently occurred. The aim of this study was to investigate the histologic, immunophenotypic and molecular features of HCCC. Methods: Eight cases of salivary gland HCCC diagnosed at the Department of Pathology, Fudan University Shanghai Cancer Center from January 2015 to October 2019 were collected. Clinicopathologic characteristics were analyzed, and fluorescence in situ hybridization (FISH) assay was used to detect EWSR1 translocation in tumor tissue. Diagnostic criteria and differential diagnosis were summarized, with a review of the literature. Results: All patients were female, aged 26 to 68 years, and the tumor locations included the oral cavity, nasopharynx, parotid gland and other sites of head and neck. Microscopically, the tumors consisted mainly of clear cells and eosinophilic cells with variable proportions, arranged in nests, sheets and trabeculae. In 1 case, the tumor was composed almost entirely of eosinophilic cells; in 6 cases, obvious nuclear pseudo-inclusion bodies were seen; in 1 case, neoplastic cells were connected to the surface squamous epithelium; in 1 case, the glandular structure was seen in some areas of the tumor; in 3 cases, a sheath of lymphocyte was formed around the tumor nests; in 7 cases, there was a sclerosing or hyalinizing stromal reaction, showing desmoplastic changes; and 1 case featured stoma with myxoid changes. There was no definite keratinization or necrosis in all tumors, and mitotic figures were generally rare. Immunohistochemical staining showed that tumor cells of 8 cases were diffusely positive for AE1/AE3 protein, 7 cases expressed P63, and 7 cases focally expressed low molecular weight keratin CK7 or CAM5.2, however, S-100, calponin, PAX-8 and CD10 were all negative. All tumors showed low proliferative activity, with the Ki-67 proliferation index less than 5%. FISH test revealed EWSR1 translocation in all 8 cases. All patients demonstrated no recurrence or metastasis during the follow up ranging 4-50 months. Conclusions: HCCC of salivary gland is a low-grade malignancy occurring mainly in minor salivary glands, with characteristic histological and molecular features. This cancer type needs to be distinguished with many morphologic mimics of salivary gland. Most cases with salivary HCCC feature a good prognosis.
[Key words] Salivary gland tumours; Hyalinizing clear cell carcinoma; Clinicopathologic features
涎腺玻璃样变透明细胞癌(hyalinizing clear cell carcinoma,HCCC)是好发于口腔内小涎腺的少见肿瘤,最常见于腭、舌根、颊黏膜、口底,生物学低度恶性。该肿瘤最初由Batsakis[1]于1980年描述,后来由Simpson等[2]和Milchgrub等[3]完善概念。HCCC 曾在《美国军事病理研究所(Armed Forces Institute of Pathology,AFIP)病理学图谱分册》[4]、第3版《世界卫生组织(World Health Organization,WHO)头颈部肿瘤病理学和遗传学分类》[5]、第4版《WHO头颈部肿瘤分类》[6]中分别被命名为透明细胞腺癌、透明细胞癌(非特指性)和透明细胞癌。2022年第5版WHO《头颈部肿瘤分类》[7]又将其重新命名为HCCC。该肿瘤以前被称为下列肿瘤的单形性变异型或与其混淆:即上皮-肌上皮癌、黏液蛋白缺失的黏液表皮样癌和肌上皮癌。因为缺乏明显的鳞状、黏液和肌上皮分化,该肿瘤成为独立的疾病实体[3]。后来研究发现,该疾病最常见的遗传学改变是EWSR1-ATF1基因融合[8],而在其他任何类型的涎腺肿瘤中目前都没有发现这种分子改变,进一步支持其为独立的疾病实体。该肿瘤典型形态学特点是透明细胞增生伴显著玻璃样变性的间质反应。由于罕见,该肿瘤不为病理科医师和临床医师所熟知,且许多其他类型原发和转移性涎腺肿瘤常见透明细胞成分,因而误诊时有发生。为加深对该肿瘤的认识,本文通过8例存档病例,探讨此类肿瘤临床病理学特征及鉴别诊断要点。
1 资料和方法
1.1 病例来源
收集复旦大学附属肿瘤医院病理科2015年1月—2019年10月诊断的涎腺HCCC 8例,均为会诊病例。调阅所有切片,由2位有经验的头颈亚专科病理科医师根据肿瘤形态学特点、并结合免疫组织化学和分子病理学检测独立复核诊断。通过电子病例或电话咨询获取患者的随访信息。
1.2 方法
1.2.1 H-E染色
标本经4%的中性甲醛溶液固定、脱水、石蜡包埋和常规4 μ m切片,行苏木精-伊红(hematoxylin and eosin,H-E)染色。将染色后的H-E切片置于显微镜下观察。
1.2.2 免疫组织化学检测
免疫组织化学染色采用全自动免疫组织化学仪(BenchMark XT,美国Roche公司)。所选一抗包括AE1/AE3、CK7(丹麦Dako公司,克隆号分别为AE1/AE3和OV-TL 12/30)、S-100(丹麦Dako公司,多克隆抗体)、P63、Ki-67 (美国Roche公司,克隆号分别为4A4和30-9)、CAM5.2(美国Becton Dickinson公司,多克隆抗体)、PAX8(美国Cellmarque公司,克隆号为MRQ-50)、CD10(福州迈新生物技术开发有限公司,克隆号为MX002)、Calponin(上海杰浩生物技术有限公司,克隆号为CALP)。具体操作步骤参考试剂盒说明书和全自动免疫组织化学标准操作流程。各抗体工作浓度参照公司产品推荐表。染色时以已知阳性病例作为对照,以PBS液取代一抗作为阴性对照。S-100阳性信号定位于细胞核和细胞质,AE1/AE3、CK7、CAM5.2和Calponin定位于细胞质,CD10定位于细胞膜, PAX8和P63定位于细胞核。
1.2.3 特殊染色
采用过碘酸雪夫氏染色(periodic acid-Schiff,PAS)方法标记肿瘤细胞中的糖原。PAS染色采用全自动特殊染色仪(美国Roche公司)。具体操作步骤参考试剂盒说明书和全自动特殊染色仪标准操作流程。阳性信号定位于细胞质,呈紫红色,显示细胞内糖原。
1.2.4 荧光原位杂交(fluorescence in situ hybridization,FISH)
FISH检测采用EWSR1双色荧光分离探针试剂盒(美国雅培公司),5’端着丝粒探针标记为红色,3’端标记为绿色。步骤如下:经常规烤片、脱蜡、纯水预处理、胃蛋白酶消化、漂洗、固定、脱水,待组织干燥后,加探针工作液,封边,杂交,在荧光显微镜下观察结果。FISH阳性结果判读标准:若肿瘤细胞内出现红、绿分离信号(间距≥2个信号点直径)或单独红色信号时,则视为阳性。当阳性细胞数占所有肿瘤细胞的比值≥30%时,诊断为有EWSR1基因相关易位;当比值<10%时,则诊断为无EWSR1基因相关易位;当比值为10%~30%时,视为不确定,需进一步验证。
2 结 果
2.1 临床资料
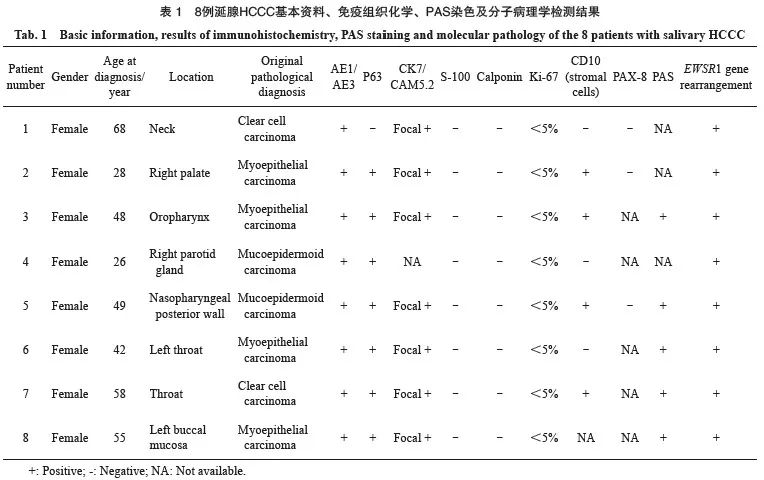
患者均为女性,发病年龄26~68岁,中位年龄48.5岁。其中6例原发于头颈区黏膜小涎腺,1例位于腮腺,1例为颈部转移灶。只有2例原诊断单位确诊为涎腺HCCC,其他均误诊为黏液表皮样癌或肌上皮癌。患者基本信息及原诊断结果见表1。随访4~50个月,所有患者均无复发或转 移。
2.2 组织形态学特点
所有病例肿瘤边界不清,呈浸润性生长。肿瘤细胞形态温和,呈多边形或圆形,细胞质透明至嗜伊红色,大部分病例由透明细胞和嗜酸性细胞按不同比例混合构成。细胞核圆形至卵圆形,染色质较均匀,核仁不明显或隐约可见小核仁,仅1例有明显的大核仁。值得注意的是,6例可见明显的核内假包涵体(图1A)。肿瘤细胞呈巢团状、片状、梁索状、列兵样排列。7例具有硬化性或玻璃样变性的间质,亦或出现促纤维结缔组织反应性间质,1例间质伴有黏液变性。所有肿瘤均未见明确角化、坏死,核分裂象罕见。除了上述经典形态,这些病例较为特殊的形态学改变包括以下发现:1例肿瘤几乎完全由嗜酸性细胞构成,仅癌巢中见到散在的透明细胞,且癌巢及间质中均见钙化灶存在(图1B);1例肿瘤组织与表面黏膜鳞状上皮相连(图1C);1例肿瘤部分区域可见腺管样结构(图1D)、基底细胞样排列以及灶区囊性变(图1E);3例肿瘤癌巢周围形成淋巴细胞套,但肿瘤内部未见炎细胞浸润(图1F)。
2.3 免疫组织化学染色
8例肿瘤弥漫表达AE1/AE3,7例表达P63(图1G),7例灶性瘤细胞表达低分子角蛋白CK7或CAM5.2,所有肿瘤增殖活性较低,Ki-67增殖指数均小于5%。所有病例瘤细胞均不表达S-100、CD10、Calponin、PAX8。4例肿瘤间质细胞CD10阳性(图1H、表1)。
2.4 特殊染色
4例行PAS染色,肿瘤细胞的细胞质均见阳性染色(图1I、表1)。
2.5 EWSR1基因相关易位检测
FISH检测结果显示,8例均有EWSR1基因相关易位(图1J)。
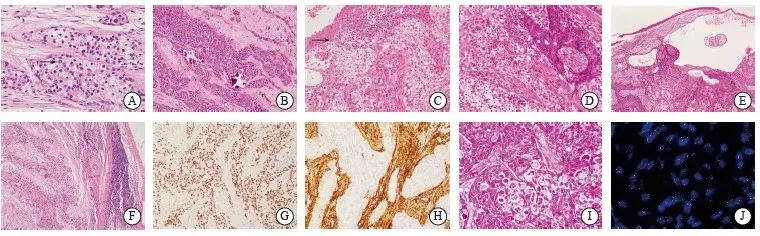
图1 涎腺HCCC代表性组织学图像
Fig. 1 Representative histological images of HCCC
A: Arrow indicated pseudo-inclusion bodies in the nuclei of neoplastic cells (H-E, ×400); B: The tumors were composed mainly of eosinophilic cells, with calcifications present within solid tumor cell nests (H-E, ×200); C: Arrow indicated the neoplastic cells were connected to the surface squamous epithelium (H-E, ×200); D: Neoplastic cells formed glandular structures (H-E, ×200); E: Focal cystic change was shown (H-E, ×40); F: Peritumoral lymphoid aggregates were shown (H-E, ×100); G: Neoplastic cells showed strong nuclear staining for p63 protein (immunohistochemistry,×200); H: CD10-positive signals were the evident in the stromal cells of the tumor (immunohistochemistry, ×200); I: Cytoplasm of the tumor cells stained positively for PAS (PAS, ×200); J: FISH assay with break-apart probe showed the presence of EWSR1 gene rearrangement.
3 讨 论
1994年,Milchgrub等[3]对11例主要发生于小涎腺、具有特定组织形态学特点及免疫表型的肿瘤进行分析总结,并将其命名为HCCC。2017年出版的《WHO头颈部肿瘤分类》[6]将其命名为涎腺透明细胞癌,定义该类肿瘤为由细胞质透明的恶性肿瘤细胞构成的低度恶性涎腺肿瘤,伴或不伴间质硬化,具有鳞状细胞样表型而缺乏其他富于透明细胞的涎腺腺癌的特征。2022年第5版《WHO头颈部肿瘤分类》[7]又将其重新命名为HCCC。
涎腺HCCC发病率极低,最大宗的流行病学数据来自于Sharbel等[9]的研究。他们分析了美国国立癌症研究所监测、流行病学和最终结果(Surveillance, Epidemiology, and End Results, SEER)数据库中198例涎腺HCCC,发现患病中位年龄为63.5岁,男女性别比例相似,63.1%发生于小涎腺(其中口腔占55.2%),36.9%发生于大涎腺。而Daniele等[10]总结了152例涎腺HCCC,结果显示,患者的平均发病年龄为56岁,男女性别比1.0∶1.6。其中80%发生于口腔小涎腺,9%发生于大涎腺,11%位于头颈其他部位。本研究报道的患者均为女性,75%(6/8)的肿瘤发生于头颈区小涎腺,12.5%(1/8)发生于大涎腺,也提示女性更常见,且小涎腺是HCCC较常见的发病部位。涎腺HCCC好发于口腔部位,肿瘤通常位于黏膜下,典型症状表现为肿胀,有时可能出现溃疡[4]。
组织学方面,本研究中所有病例肿瘤边界不清,均呈浸润性生长。肿瘤细胞常排列成小梁状、索状或实性巢团,少数病例可见基底细胞样排列,癌巢中偶见角化形成。较为少见的形态改变包括:肿瘤细胞含有胞质内黏液,甚至有腺体形成;局部囊性变,囊内壁衬以透明细胞[11]。玻璃样变性的纤维、胶原间质围绕癌巢或嵌入癌巢内部而形成假筛样结构。大部分病例还可见到促纤维结缔组织反应性间质,部分病例间质有黏液变性。本研究也发现,HCCC可以出现多样化的形态学改变,当看到黏液细胞(无论数量如何)、基底样细胞、局灶的腺样分化、囊性变、以嗜酸性细胞为主要成分的涎腺肿瘤时,也不能完全排除HCCC的可能性,需仔细寻找有无典型的HCCC的形态学特征,并加以免疫组织化学或者分子检测辅助诊断。
就免疫组织化学及分子表型而言,所有病例肿瘤细胞弥漫强阳性表达AE1/AE3,绝大部分病例弥漫表达CK5/6、P63、CK14,大部分病例可不同程度的表达低分子角蛋白CK7或CAM5.2,均不表达S-100、Calponin等肌上皮标志物。我们的结果显示部分病例间质细胞弥漫强阳性表达CD10,或许有一定的辅助诊断价值。有学者[12]发现口咽部的涎腺HCCC P16阳性,阳性率为5%~80%,但RNA原位杂交结果显示高危型HPV均为阴性,病毒感染与否及其与肿瘤发生之间的关系仍有待进一步研究。Antonescu等[8]采用FISH检测了23例涎腺HCCC,并以具有透明细胞形态特点的上皮-肌上皮癌和黏液表皮样癌作为对照,发现18例HCCC具有EWSR1基因相关易位,并进一步证实EWSR1和ATF1基因融合。EWSR1基因是转录因子TET家族的成员,位于染色体22q12上。EWSR1编码一种参与基因表达、细胞信号转导、RNA加工和转运的RNA结合蛋白,并作为转录阻遏物发挥作用。ATF1基因位于12号染色体上,编码一种作为CREB元件的激活转录因子[13]。嵌合蛋白通过EWSR1外显子11和ATF1外显子3中的断点融合形成[t(12; 22) (q13; q12)]。2018年Chapman等[14]报道分别发生于舌根、肺和鼻咽的3例呈显著黏液分化的HCCC具有EWSR1-CREM基因融合。本研究中的8例患者通过FISH检测均出现EWSR1基因相关易位,进一步证实为HCCC。
多种涎腺原发性肿瘤以及部分转移性癌可具有透明细胞形态,鉴别诊断尤为重要:
① 黏液表皮样癌:这是最容易与HCCC相混淆的肿瘤,特别当其仅由透明样细胞和表皮样细胞构成时,此时黏液表皮样癌中的中间型细胞与HCCC中的嗜酸性细胞很相似,而且高达50%的HCCC病例中会出现局灶性黏液分化[15-16],特别是在疑难病例或者小活检标本中,仅靠形态和免疫组织化学不易区分,需行EWSR1和(或)MAML2基因易位检测辅助诊断。Hsieh等[16]对49例黏液表皮样癌进行MAML2融合基因检测,在阴性组再检测EWSR1基因重排情况,结果显示3例有EWSR1基因重排,而重新诊断为HCCC。② 肌上皮癌:透明细胞型肌上皮癌与HCCC形态相似,仅凭形态鉴别较为困难,但免疫组织化学染色能够提供较大帮助,因为HCCC通常不表达S-100、Calponin、SMA等肌上皮相关标志物。③ 伴有透明细胞样特点的涎腺鳞状细胞癌:涎腺鳞状细胞癌罕见,多数情况下细胞异型性明显,细胞核大小不一、不规则,核分裂象易见,可见如角化、间桥等鳞癌特点,或鳞状上皮异型增生移行至鳞癌的形态改变。④ 转移性肾透明细胞癌:肾透明细胞癌转移到涎腺或头面部偶有发生[17]。就形态而言,肾透明细胞癌的癌巢之间有丰富的充满红细胞的毛细血管网,这在涎腺HCCC几乎不可见。此外,肾透明细胞癌几乎不表达P63、CK5/6,其他肾癌标志物染色也有助于进一步确诊。
Daniel等[10]发现,涎腺HCCC患者初诊时多为局限性病灶,部分发生局部淋巴结转移,极少数发生远处转移。患者5、10和20年疾病特异性生存率(disease-specific survival,DSS)分别为81.3%、69.6%和55.3%。病变局限且仅行手术切除治疗的患者5、10年DSS可分别达96.4%和86.3%。单一手术治疗、手术联合放疗、单一放疗的10年DSS分别86.3%、57.6%和18.8%。结果显示,女性患者、无淋巴结转移、无远处转移的患者预后较好,而手术切除可能也是目前最为合适的治疗方式。要避免误诊,以防对患者造成不必要的过度治疗和加重心理负担。患者的总体预后较好[18]。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] BATSAKIS J G. Clear cell tumors of salivary glands[J]. Ann Otol Rhinol Laryngol, 1980, 89(2 Pt 1): 196-197.
[2] SIMPSON R H W, SARSFIELD P T L, CLARKE T, et al. Clear cell carcinoma of minor salivary glands[J]. Histopathology, 1990, 17(5): 433-438.
[3] MILCHGRUB S, GNEPP D R, VUITCH F, et al. Hyalinizing clear cell carcinoma of salivary gland [J]. Am J Surg Pathol, 1994, 18(1): 74-82.
[4] ELLIS G L, AUCLAIR P L. Armed forces Institute of pathology (AFIP) atlas of tumor pathology. Tumors of the salivary glands(fourth series, fascicle 9) [M]. Maryland: ARP Press, 2008.
[5] THOMPSON L. World health organization classification of tumours: pathology and genetics of head and neck tumours[J]. ENT J, 2006, 85: 74-74.
[6] EL-NAGGAR A K, CHAN J K C, GRANDIS J R, et al. WHO classification of head and neck tumours [M]. Lyon: IARC, 2017.
[7] WHO Classification of Tumours Editorial Board. Head and neck tumours. WHO classification of tumours series, 5th ed [M]. Lyon: IARC Press, 2022.
[8] ANTONESCU C R, KATABI N, ZHANG L, et al. EWSR1-ATF1 fusion is a novel and consistent finding in hyalinizing clear-cell carcinoma of salivary gland[J]. Genes Chromosomes Cancer, 2011, 50(7): 559-570.
[9] SHARBEL D D, UNSAL A A, GROVES M W, et al. Salivary clear cell carcinoma clinicopathologic characteristics and outcomes: a population-based analysis[J]. Ann Otol Rhinol Laryngol, 2019, 128(11): 989-996.
[10] DANIELE L, NIKOLARAKOS D, KEENAN J, et al. Clear cell carcinoma, not otherwise specified/hyalinising clear cell carcinoma of the salivary gland: the current nomenclature, clinical/pathological characteristics and management[J]. Crit Rev Oncol Hematol, 2016, 102: 55-64.
[11] 石麒麟, 夏 慧, 张晓岚, 等. 涎腺玻璃样变透明细胞癌临床病理分析[J]. 中华病理学杂志, 2015, 44(1): 53-54.
SHI Q L, XIA H, ZHANG X L, et al. Clinicopathological analysis of hyaline cell carcinoma of salivary gland [J]. Chin J Pathol, 2015, 44(1): 53-54.
[12] BISHOP J A, ROOPER L M, CHIOSEA S I, et al. Clear cell carcinoma of salivary glands is frequently p16 positive: a pitfall in the interpretation of oropharyngeal biopsies[J]. Am J Surg Pathol, 2018, 42(3): 367-371.
[13] DE CESARE D, SASSONE-CORSI P. Transcriptional regulation by cyclic AMP-responsive factors[J]. Prog Nucleic Acid Res Mol Biol, 2000, 64: 343-369.
[14] CHAPMAN E, SKALOVA A, PTAKOVA N, et al. Molecular profiling of hyalinizing clear cell carcinomas revealed a subset of tumors harboring a novel EWSR1-CREM fusion: report of 3 cases[J]. Am J Surg Pathol, 2018, 42(9): 1182-1189.
[15] TANGUAY J, WEINREB I. What the EWSR1-ATF1 fusion has taught us about hyalinizing clear cell carcinoma[J]. Head Neck Pathol, 2013, 7(1): 28-34.
[16] HSIEH M S, WANG H, LEE Y H, et al. Reevaluation of MAML2 fusion-negative mucoepidermoid carcinoma: a subgroup being actually hyalinizing clear cell carcinoma of the salivary gland with EWSR1 translocation[J]. Hum Pathol, 2017, 61: 9-18.
[17] MAJEWSKA H, SKÁLOVÁ A, RADECKA K, et al. Renal clear cell carcinoma metastasis to salivary glands - a series of 9 cases: Clinico-pathological study[J]. Pol J Pathol, 2016, 67(1): 39-45.
[18] YAMASHITA K, KAWAKAMI F, NAKASHIMA Y, et al. Clear cell carcinoma of the minor salivary gland: an autopsy case with multiple metastases 29 years after the initial surgery and a review of the literature[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2009, 107(6): 819-825.


