大卫·辛克莱发表Cell论文:表观遗传才是衰老的主要驱动力,逆转衰老成为可能
时间:2023-01-15 18:01:55 热度:37.1℃ 作者:网络
2022年12月19日,哈佛大学教授、著名衰老研究科学家大卫·辛克莱(David Sinclair)发布推特,宣布自己一项历时13年的开创性衰老研究成果被顶级学术期刊接收。
他表示,这项研究始于2009年,那时候还没有DNA甲基化时钟和CRISPR基因编辑技术。他还提到,这篇论文在三年前被拒稿,团队进行了两年的改进工作,又将另一篇论文合并进来,并继续工作了一年,最终论文被顶刊接收。

2023年1月12日,谜底揭开,这项研究发表在了 Cell 期刊,论文题为:Loss of epigenetic information as a cause of mammalian aging。
这项历时13年的研究证明了,表观遗传变化是导致哺乳动物衰老的主要原因,而恢复表观基因组的完整性可以逆转衰老的迹象。
David Sinclair表示,这项研究意味着,癌症、糖尿病、阿尔茨海默病这些年龄相关疾病可能有相同的潜在病因,可以通过单一治疗逆转,从而治疗或治愈与年龄有关的疾病,自己的实验室也正在对此进行测试。

大卫·辛克莱(David Sinclair),是哈佛医学院遗传学系教授和 Paul F. Glenn 衰老研究生物学中心联合主任。他因人类为何会衰老以及如何减缓衰老的一系列研究而声名鹊起。例如,NMN的火爆,很大程度上是因为他的研究和宣传。他还曾表示“我们没有理由活不到200岁”(There is no reason we couldn't live 200 years)。

大卫·辛克莱(David Sinclair)
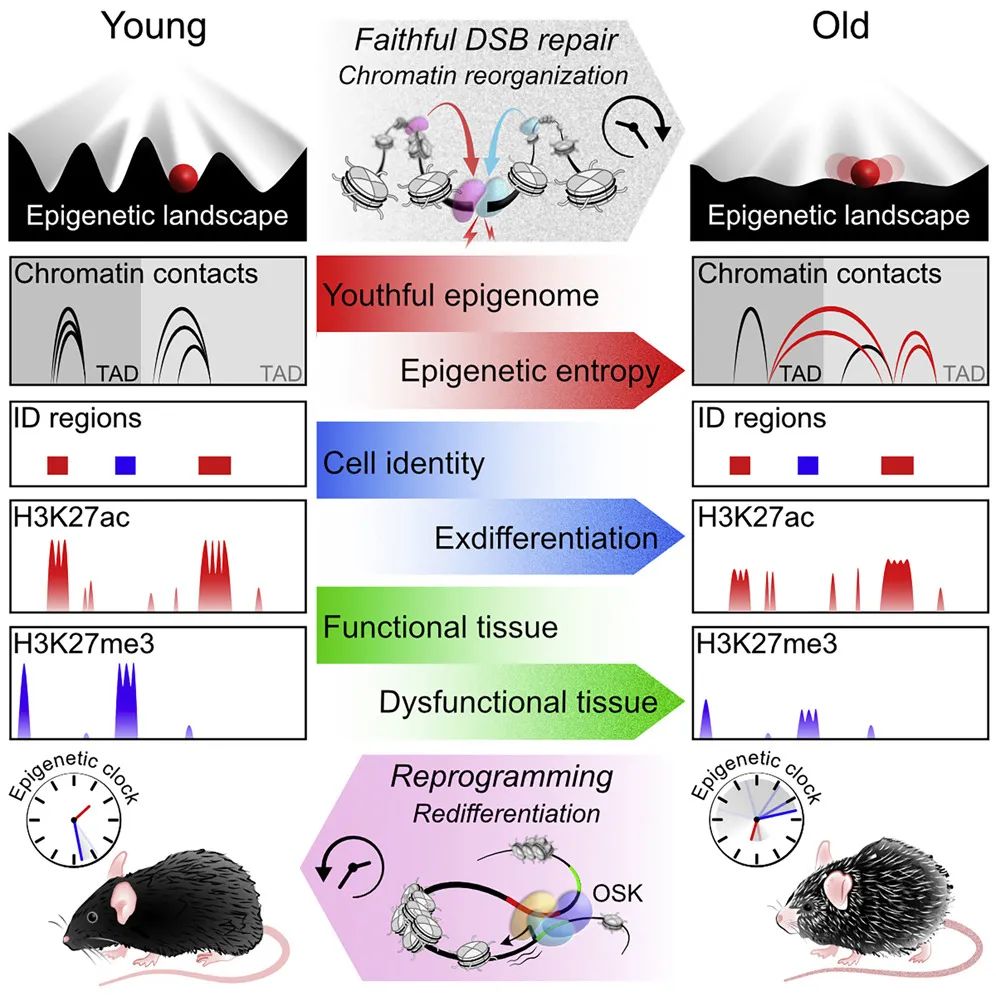
这项历时13年的研究通过一系列实验证实了DNA变化不是衰老的唯一原因,甚至不是主要原因。染色质(组成染色体的DNA和蛋白质复合物)的化学和结构变化在不改变遗传基因序列(即表观遗传变化)的情况下加速衰老。
论文通讯作者 David Sinclair 表示,这是第一个证明一个表明表观遗传变化是哺乳动物衰老的主要驱动因素的研究。
论文第一作者 Yang Jae-Hyun 表示,预计这些发现将改变我们看待衰老过程的方式,以及我们治疗与衰老相关疾病的方式。
对表观遗传过程进行调控比逆转DNA突变更容易,这项研究提示了我们,通过表观遗传学而不是遗传学来预防和治疗与年龄相关的疾病和损伤或许是更好的途径。
David Sinclair 表示,希望这篇论文的发表被视为人类拥有调控衰老能力的转折点,这是第一次实现精确调控复杂的哺乳动物的生物学年龄的研究,实现了随意控制生物学年龄前进或后退。目前团队正在非人灵长类动物中验证这一发现。
对于研究衰老的科学家们来说,最迫切要解答的问题,可能是衰老的原因是什么。
几十年来,衰老研究领域的一个主流理论是——衰老源于DNA变化的积累,主要是基因突变,随着时间的推移,这些DNA变化会阻止越来越多的基因正常运作。这些故障反过来会导致细胞失去它们的特性,从而导致组织和器官崩溃,最终导致疾病和死亡。
然而,近年来,越来越多的研究表明,事情并非如此。例如,有研究发现,一些具有高突变率的人和小鼠没有表现出过早衰老的迹象。而许多类型的衰老细胞却很少或没有突变。
研究人员们想知道,是不是还有还有什么因素导致衰老,或与DNA变化一起导致衰老,可能的罪魁祸首越来越多,其中就包括表观遗传变化。
表观遗传学的一个组成部分是物理结构,例如组蛋白,组蛋白将DNA捆绑成致密压缩的染色质,并在需要时解开部分DNA,当它们被解开时,才可以进行复制、转录,以及生产蛋白质。因此,表观遗传因子能够决定特定时间里特定细胞的哪些基因是活跃还是不活跃。
对于生物体而言,每个细胞上基本都有相同的DNA,但不同细胞的表型却有明显差异。例如人类,皮肤细胞、心脏细胞、肌肉细胞、神经细胞,虽然有着相同的DNA,但无论是外形还是功能,都截然不同。这正是表观遗传分子作为基因活动的开关,帮助决定了不同细胞的类型和功能。
通俗地说,表观遗传学就像是细胞的一个操作系统,告诉不同细胞如何以不同的方式使用相同的遗传物质。
早在20世纪90年代末和21世纪初,David Sinclair 实验室等就在酵母和哺乳动物中发现,表观遗传变化伴随着衰老。然而,当时还不知道这些表观遗传变化是导致衰老的原因,还是衰老带来的结果。
而直到这项研究,David Sinclair 团队才能够将表观遗传从遗传变化中分离出来,并证实了表观遗传信息的崩溃确实会导致小鼠衰老。
在这项研究中,David Sinclair 团队的主要实验涉及在实验室小鼠的DNA中创建临时的、可快速修复的DNA断裂。这模拟哺乳动物细胞每天在呼吸、阳光和宇宙射线,以及接触某些化学物质时染色体中持续发生的低概率的DNA断裂。为了测试这一过程是否会导致衰老,研究团队增加了DNA断裂的次数,以模拟快进的生命。
该团队确保大多数DNA断裂不是发生在小鼠DNA的编码区域内,DNA编码区域是组成基因的部分,这种DNA断裂防止了小鼠发生基因突变,但会改变DNA的折叠方式。
研究团队将这一系统称为ICE(Inducible Changes to the Epigenome),即表观基因组诱导变化的缩写。
一开始,表观遗传因子会暂停它们正常的调控基因的工作,转移到DNA断裂处协调修复。之后,这些表观遗传因子回到了它们原来的位置。但随着时间的推移,情况发生了变化。研究团队注意到,这些表观遗传会“迷失”,在帮助修复断裂后不再返回。这导致表观基因组变得杂乱无章,开始失去原始信息,染色质以错误的模式压缩和解开,这是表观遗传功能障碍的标志。
当小鼠失去了年轻时的表观遗传功能时,它们的外表和行为开始变得衰老。研究团队发现了它们的衰老生物标志物增加,细胞失去了原有特性,组织和器官功能失调。
研究团队还使用 David Sinclair 实验室最近开发的工具来测量小鼠的生物学年龄,这一工具是基于基因组中的甲基化水平来评估生物学年龄(随着衰老的进行,DNA甲基化水平会随之增加)。与同期出生的小鼠相比,ICE小鼠明显衰老得更多。
接下来,研究团队对这些小鼠进行基因治疗,以逆转这些表观遗传变化。
早在2020年12月,David Sinclair、吕垣澄等人发表 Nature 封面论文,通过腺相关病毒(AAV)将Oct4、Sox2、Klf4这三个基因递送到小鼠视网膜(OSK疗法),诱导了神经节细胞重编程,恢复年轻的表观遗传信息,逆转了青光眼和衰老造成的视力下降。
2012年诺贝尔奖得主山中伸弥教授发现Oct4、Sox2、Klf4 和 c-Myc这四个转录因子,可以诱导成熟细胞的重编程,将其转化为iPSC。此后许多团队尝试将这一方法应用于体内重编程时,发现会导致畸胎瘤的发生。正是David Sinclair、吕垣澄等人在这篇 Nature 论文中证实,c-Myc是导致畸胎瘤的主要原因,使用Oct4、Sox2、Klf4这三个因子就能够在体内安全诱导重编程。
而就在2023年1月5日,乔治·丘奇(George Church)创立的抗衰老公司Rejuvenate Bio的研究人员在预印本平台bioRxiv发表论文,通过AAV表达Oct4、Sox2、Klf4这三个因子(OSK疗法),将野生型老年小鼠的剩余寿命翻倍。详情点击:将老年小鼠剩余寿命翻倍,乔治·丘奇创立的抗衰老公司将开展人体临床试验
这项发表在 Cell 的研究中,研究团队继续使用了上述OSK疗法,让ICE小鼠的器官和组织恢复了年轻状态。
David Sinclair 表示,这就像是重启一台有故障的电脑。这种疗法启动了一个表观遗传程序,使衰老细胞恢复了它们年轻时拥有的表观遗传信息,而这是一种永久性重置。这些发现支持了一种假说:哺乳动物细胞维持着一种表观遗传软件的备份副本,当被访问时,可以将衰老的、表观遗传混乱的细胞重启到年轻、健康的状态。
这也意味着,我们可以通过操纵表观基因组,加速衰老或逆转衰老。
总的来说,该研究开发了一种名为表观基因组诱导变化(Inducible Changes to the Epigenome,ICE)的方法,ICE方法为研究人员探索表观遗传学在衰老和其他生物过程中的作用提供了新的途径。ICE小鼠仅在6个月后就出现了衰老迹象,而不是像其他小鼠那样在两年半左右才出现衰老迹象,这将为衰老研究节省了时间和金钱。
该研究还通过OSK基因疗法逆转衰老小鼠的生物学年龄,除此之外,还有其他方法,例如使用药物或小分子化学物质来调控表观遗传,从而超越OSK基因疗法。
最后,David Sinclair 总结道,心血管疾病、2型糖尿病、神经退行性疾病、衰弱,这些都是年龄相关的疾病和状况,也是衰老的表现,当这些情况出现时,我们一直试图进行药物治疗,但往往为时已晚。解决衰老的根本原因,以延长人类寿命,尤其是健康寿命,想实现这一目标还有很长的路要走,但科学家应该胸怀大志,为了实现这样的梦想而不断尝试。
原始出处:
Jae-Hyun Yang, et al. Loss of epigenetic information as a cause of mammalian aging. Cell, 2023.


