Cell子刊:张好建团队揭示急性髓系白血病中m6A修饰动态变化及PRMT6的调控作用和机制
时间:2022-12-29 18:00:06 热度:37.1℃ 作者:网络
急性髓系白血病(AML)是一类由于髓系祖细胞分化阻滞、恶性增殖引起的恶性血液肿瘤。遗传或表观遗传变化积累将正常造血干/祖细胞(HSPCs)转化为白血病干细胞(LSCs),从而起始AML发生发展。AML临床治疗仍然面临巨大挑战,目前多采用联合化疗方式,预后较差,5年总体生存率小于30%。因此,迫切需要深入探索AML发病机制、寻找新的治疗靶点和探索新的治疗策略。
2022年12月26日,武汉大学医学研究院/免疫与代谢前沿科学中心/口腔医学院/泰康生命医学中心张好建团队在 Cell Stem Cell 期刊发表了题为:Decoding m6A RNA methylome identifies PRMT6-regulated lipid transport promoting AML stem cell maintenance 的研究论文【1】。
该研究解码了AML发生过程中RNA m6A修饰动态变化,发现了关键分子PRMT6并阐明其调控AML发生发展和LSC功能的重要作用与机制,为AML临床治疗提供潜在治疗策略。

在这项研究中,研究团队通过MeRIP-seq 测序方法解码了白血病起始细胞(LICs)的RNA m6A修饰组学,确定了3587个高可信度的m6A修饰靶点;与正常造血干祖细胞群体的m6A修饰组进行比较并结合表达水平变化分析,发现在AML发生过程中m6A修饰正调控干细胞自我更新相关基因表达,提示m6A参与白血病起始细胞干性获得。鉴于不同阅读蛋白在m6A修饰mRNA的命运决定中起重要作用,研究团队通过RIP-seq解析了不同阅读蛋白在白血病起始细胞中的靶点。
该研究进一步聚焦于阅读蛋白IGF2BP2,发现其表达在AML病人样品中高表达,并与患者不良预后息息相关;IGF2BP2 缺失促进细胞凋亡,损伤白血病干细胞功能并抑制AML发生发展。有意思的是,研究团队在白血病起始细胞自我更新相关潜在关键基因中发现了蛋白精氨酸甲基转移酶PRMT6,证实IGF2BP2识别PRMT6 mRNA稳定性受到IGF2BP2 调控,是IGF2BP2下游功能靶点。研究团队发现PRMT6在AML样本中高表达,维持了白血病干细胞功能;PRMT6敲除则抑制了AML发生发展。
该研究进一步证实PRMT6抑制剂EPZ020411能有效抑制白血病干细胞功能。已有研究表明PRMT6主要催化抑制性标记H3R2me2a形成。研究团队通过开展H3R2me2a ChIP-seq,并整合分析RNA-seq数据,发现PRMT6下游关键靶基因脂质转运分子MFSD2A。证实PRMT6通过催化H3R2me2a 修饰抑制MFSD2A表达,从而调控脂肪酸比如二十二碳六烯酸DHA的转运,维持白血病干细胞功能。
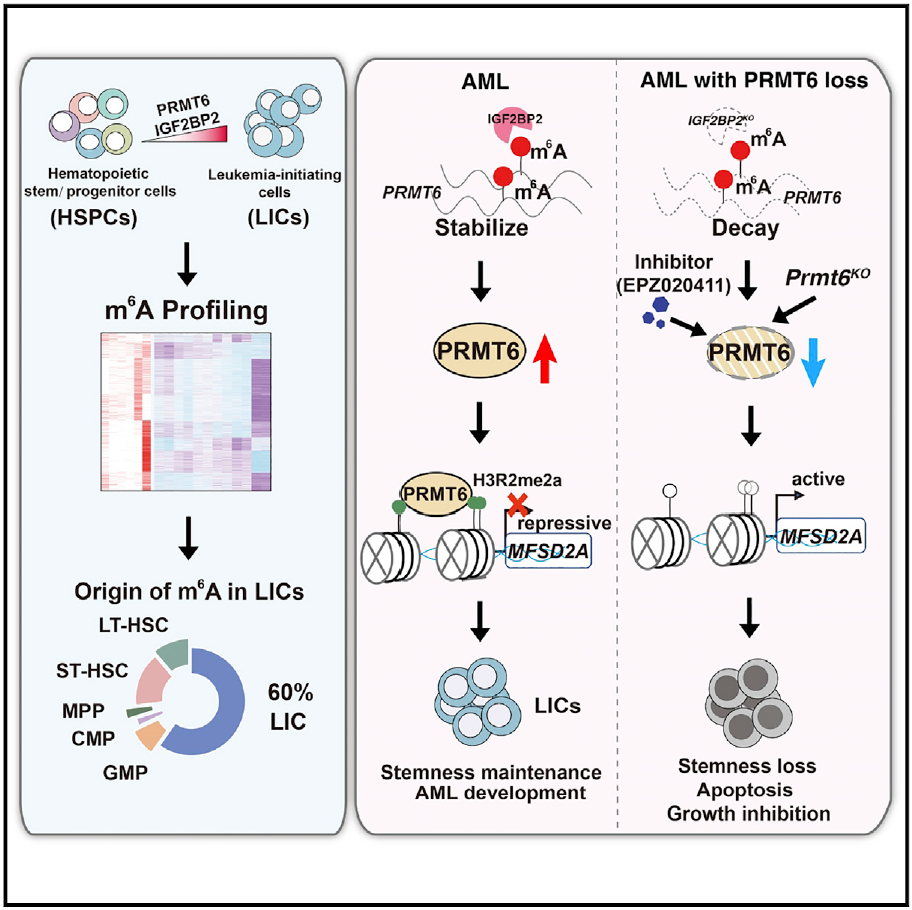
综上,该研究解析了白血病发生过程中RNA m6A修饰变化规律,阐明了PRMT6-MFSD2A信号轴调控白血病干细胞干性维持的重要功能,揭示了PRMT6抑制剂EPZ020411杀伤白血病干细胞并抑制AML发生发展的潜力。该工作将有助于我们深入理解AML发病机制,将为AML临床治疗提供重要理论依据和靶向新策略。
据悉,该研究是张好建团队相继于2020年5月、2021年10月在 Cell Stem Cell 发表的两项工作的深入【2、3】。
武汉大学免疫与代谢前沿科学中心/医学研究院博士生程颖、高竹英和张田田为论文的共同第一作者,张好建教授为论文通讯作者。武汉大学中南医院周芙玲教授、华中科技大学同济医学院附属协和医院黎玮明教授为本研究提供重要支持。该工作受到科技部重点研发计划干细胞专项、国家自然科学基金重点项目和青年项目、湖北省自然科学基金创新群体、武汉大学医学腾飞计划、中央高校自主科研项目等资助。
张好建课题组主要从事血液系统发育的分子机制和血液疾病的致病机理研究。目前研究方向包括血液系统细胞命运转化的调控机制、急性髓系白血病发病机制与靶向等。近三年来已在 Cell Stem Cell(2022;2021;2020)、Blood(2021)、Cell Reports (2022)等发表多篇论文。
论文链接:
1. https://doi.org/10.1016/j.stem.2022.12.003
2. https ://doi.org/10.1016/j.stem.2020.04.001
3. https ://doi.org/10.1016/j.stem.2021.09.014
4. https://doi.org/10.1182/blood.2020009676


