【JMC】从高亲合力大环肽到小分子先导的生成策略
时间:2022-12-03 21:00:09 热度:37.1℃ 作者:网络

对于一些宽且平坦的结合位点,通过传统的筛选策略筛选理化性质良好的小分子化合物仍具有挑战性。环肽虽然具有较高的亲合力和选择性,但较大的分子量和极性表面积导致其成药性较差。将大环肽通过骨架跃迁改造成小分子药物将是克服其缺点的一种解决方案。通过模拟生物活性肽的关键相互作用,而不具有直接的结构相似性,已成为识别小分子配体的一种有吸引力的方法。同时,肽展示技术为获得针对广泛靶标的高亲合力肽提供了可能。Shionogi药物研究中心Tachibana等人通过肽展示技术快速筛选具有高亲合力的大环肽,并依据药效团模型从头设计小分子药物,在克服肽类药物理化性质差的同时,保留了较高的亲合力。并使用烟酰胺N-甲基转移酶 (NNMT)作为靶蛋白证明该策略的适用性,相关工作以“Peptide-to-Small Molecule: A Pharmacophore-Guided Small Molecule Lead Generation Strategy from High-Affinity Macrocyclic Peptides”为题,发表在美国化学会出版社的药物化学核心期刊Journal of Medicine Chemistry上 (DOI: 10.1021/acs.jmedchem.2c00919)【1】。
活性大环肽1的鉴定和结构分析
作者首先从大环肽库中筛选得到具有NNMT抑制活性的先导肽1,并得到其与NNMT结合的共晶结构,发现其与内源性底物S-腺苷-L-高半胱氨酸 (SAH) 以及1-甲基烟酰胺 (1-MNA) 具有相同的作用模式 (图1a, b ,c)。

图1. 模板肽1与NNMT结合的共晶结构以及构效关系分析。(a) 肽1和肽2的结构; (b, c) 肽1与NNMT二聚体复合物 (NNMT的A, B链分别用绿色和青色表示;肽1为洋红色) 与SAH/1-MNA/NNMT复合物 (NNMT为浅灰色; SAH/1-MNA为橙色); (d) 肽2的丙氨酸扫描结果。
大环肽1的药效团分析
为了分析肽1的药效团,作者通过构效关系研究发现肽1的乙酰胺取代基对活性没有影响,去掉之后得到肽2。并对肽2进行丙氨酸扫描确定结构中较为重要的四个氨基酸,分别为位于SAH结合位点Arg3,位于隐藏口袋附近的HxG5、Trp6以及连接两个位点的Gly4 (图1 d)。
随后为了表征结合口袋中的药效团,作者使用基于网格的非均相溶剂化理论 (GIST) 进行水合位点分析。肽1结构中Arg3上的胍基具有与SAH结构中阳离子氨基相似的静电相互作用 (图1. c)。同时GIST分析表明,用阳离子氨基取代该位点对熵不利的水分子可以显著提高配体-蛋白质的结合亲合力 (图2. a);HxG5和Trp6的侧链位于隐藏口袋的疏水区域,两个亲脂性侧链通过置换不稳定的水分子形成疏水相互作用有助于提高结合能力 (图2b, c);Gly4和HxG5主链上的羰基作为氢键受体置换其周围熵不利的水分子同样也有助于提高结合能力 (图2. b)。由此作者将同型半胱氨酸口袋中带正电荷的基团、隐藏口袋中疏水基团以及与Tyr86 和 Val143 的主链 NH 相互作用的两个HBA作为下一步虚拟筛选查询的关键药效团 (图2. d)。

图2. 肽1与NNMT的结合模式。(a) 1与NNMT的结合模式; (b) 基于GIST的MD模拟计算的不利水分子占有率,焓和熵不利的水分子分别洋红色和绿色球体表示,疏水区域用黄色球体表示; (c) 通过SiteMap可视化分析结合口袋的性质,疏水基团、氢键受体以及氢键供体分别用黄色、红色和蓝色表示; (d) 定义的关键药效团。
基于药效团的小分子配体设计及实验评估
随后,作者根据药效团模型进行虚拟筛选,得到目标片段Virtual Hit-A。并根据对接结果不断进行优化,直至满足所有药效团所占据的位点,最终得到初始的配体11 (图3)。接着测试合成得到化合物11的生物活性,并通过核磁共振化学位移扰动实验证实11与NNMT的特异性结合。
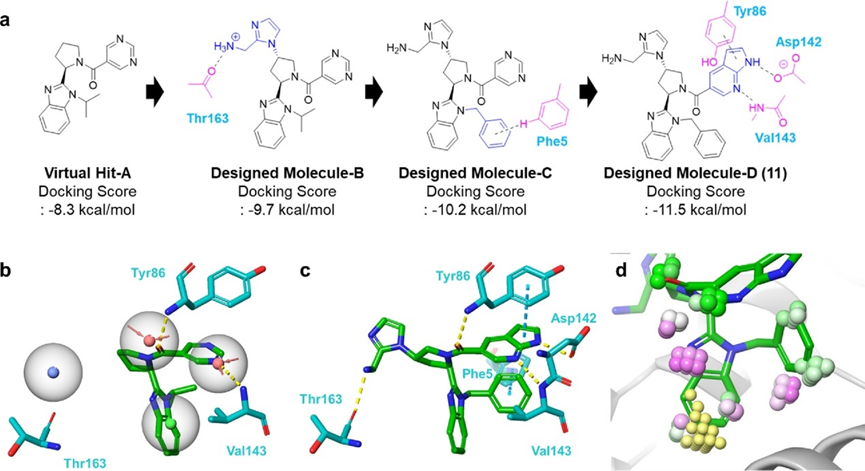
图3.根据Virtual Hit-A从头设计新型NNMT抑制剂11。(a) 虚拟化合物的结构及其设计理念; (b, c) Virtual Hit-A、11(绿色) 与NNMT (青色) 的对接模型; (d) 化合物11的对接模型与GIST分析结果的叠加。
小分子配体11的结构优化
作者依据对接模型进行结构优化,并对占据隐蔽疏水口袋中的苄基和苯并咪唑进行甲基或氯基取代,发现苯并咪唑5位上的甲基和苄基4位上的氯取代显著提高了抑制活性。作者发现活性的提高与GIST分析的结果一致,同时发现苯并咪唑中3位的极性氮原子位于疏水区域,用碳原子替代后得到的化合物13进一步提高了抑制活性 (IC50= 0.016 μM)。
与此同时,作者成功得到化合物13与NNMT的共晶结构,发现其与11的对接姿势几乎相同 (图4 a)。虽然13/NNMT复合物是作为单体获得,但其折叠结构与1/NNMT复合物的折叠结果相似(图4 b)。基于13与NNMT的共晶结构将化合物13结构中的咪唑替换成吡唑进一步提高了抑制活性(cell-free IC50 = 0.0011 μM, cell-based IC50 = 0.40 μM, CC20 > 10 μM)。
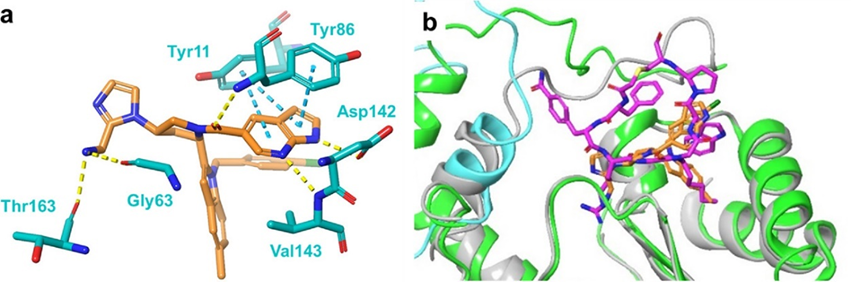
图4.小分子13与NNMT的共晶结构。(a) 13 (橙色) 与NNMT (青色) 的结合模式图; (b) 1/NNMT二聚体复合物 (NNMT的链A和链B分别为绿色和青色, 1为洋红色) 和13/NNMT复合物 (NNMT为浅灰色带, 13为橙色) 的结构叠加图
总结
作者通过使用“肽到小分子”策略,成功地鉴定了一种新型的具有细胞活性的选择性小分子NNMT抑制剂,且该策略不依赖于传统化合物库筛选。所得到的小分子14具有比模板肽1更高的抑制活性,且分子量仅为肽的一半。体外翻译肽展示技术可以快速获得高亲合力大环肽,并且基于药效团的计算方法为从头设计具有高亲合力的小分子提供了方便,这些技术的发展使得“肽到小分子”策略成为小分子药物发现的新选择,尤其是对于传统小分子筛选技术难以获得命中化合物的靶标。


