JACC CardioOncol:DLBCL治疗中的肿瘤学和心血管考量
时间:2023-07-16 23:12:31 热度:37.1℃ 作者:网络
DLBCL治疗的心脏毒性
多数弥漫大B细胞淋巴瘤(DLBCL)患者的一线治疗会包含多柔比星,它是一种蒽环类药物,与心血管毒性(包括心肌病)相关,可能禁用于既存心脏合并症的患者,此外环磷酰胺(一种氮芥烷化剂)也可引起心脏毒性,虽然相对较少。
美国心脏病学会旗下肿瘤心脏病学专业杂志《JACC: Cardiooncology》近日发表一篇综述,作者通过一个案例,讨论了基础心脏疾病患者中 DLBCL 的管理,以及多学科护理在评估和治疗这些患者中的作用。

案例报告
患者男,75岁,有高血压、糖尿病、NYHA心功能Ⅲ级心力衰竭病史,最近1个月可触及腋下及腹股沟淋巴结肿大、发热、寒战、盗汗、呼吸急促、体重减轻20磅。左腋窝淋巴结活检示DLBCL。PET/CT扫描示膈肌上下淋巴结肿大以及肺部受累(IV期疾病)。实验室检查显示乳酸脱氢酶为400U/L,血红蛋白为8g/dL。ECOG评分为1。
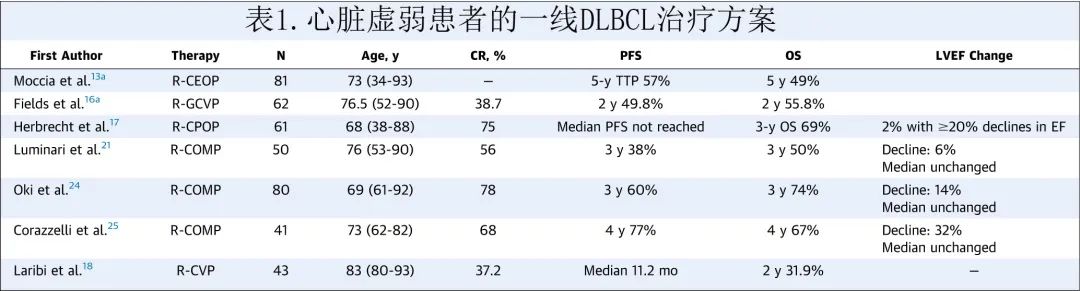
DLBCL的一线标准治疗选择
R-CHOP包括利妥昔单抗、环磷酰胺、多柔比星、长春新碱和泼尼松,过去20年一直是 DLBCL 的标准一线治疗。已有多项研究试图通过加入其他靶向药物来改善 R-CHOP 的结局,包括硼替佐米(PYRAMID研究,评估 R-CHOP 联合或不联合硼替佐米治疗既往未经治疗的non-GCB型DLBCL患者的有效性)、来那度胺(ROBUST 研究,来那度胺+R-CHOP化疗对比安慰剂+R-CHOP治疗未经治疗的 ABC 型DLBCL的疗效和安全性)和伊布替尼(PHOENIX 研究,伊布替尼联合R-CHOP治疗新诊断的non-GCB型DLBCL患者),但这些靶向药物均未对结局产生显著获益。然而最近的 POLARIX研究(在DLBCL患者中比较维泊妥珠单抗(Polatuzumab Vedotin)联合利妥昔单抗-环磷酰胺、多柔比星和泼尼松 [R-CHP] 与利妥昔单抗、环磷酰胺、多柔比星、长春新碱和泼尼松 [R-CHOP] 的疗效和安全性),是一项比较维泊妥珠单抗联合化学免疫治疗 (pola-R-CHP) 与 R-CHOP 的具有里程碑意义的 III 期研究,证明 pola-R-CHP 治疗2年时无进展生存期 (PFS) 获益6.5%,且毒性未增加。
鉴于强化 R-CHOP 联合靶向药物改善高危临床和分子特征患者预后的成功率有限,da-R-EPOCH(剂量调整的利妥昔单抗、依托泊苷、泼尼松、长春新碱、环磷酰胺、阿霉素)成为一种新的治疗骨干,专门针对高危 DLBCL 患者,如伴双打击或三打击的高级别 B 细胞淋巴瘤、原发性纵隔 B 细胞淋巴瘤、HIV相关 DLBCL 和灰区淋巴瘤。然而III期随机CALGB 50303 研究未显示 daR-EPOCH 与 R-CHOP 相比可改善 DLBCL 的生存结局。因此对于大多数 DLBCL 患者,R-CHOP仍是标准治疗选择,而强化治疗并无获益。在80岁以上的患者中,R-mini-CHOP化学免疫治疗的剂量降低安全有效,相当大比例的老年/虚弱患者可通过该方案治愈。
DLBCL一线治疗的心脏毒性
尽管蒽环类药物是 DLBCL 一线治疗 R-CHOP 中最有效的单一组分,但其也与显著的心脏毒性相关,尤其是在既存心血管疾病 (CVD)(如心肌病)的患者中。蒽环类药物诱导的心脏毒性通常具有剂量依赖性,尤其是在多柔比星剂量>250 mg/m2时,建议多柔比星的累积、终生剂量不超过400mg/m2。
除累积剂量外,多项研究还探索了与阿霉素诱导心脏毒性相关的风险因素。SEER数据库研究表明,多柔比星与心力衰竭风险增加29%相关,且该风险不仅与药物暴露相关,还与年龄增加、既往心脏病、合并症、糖尿病和高血压相关。对新诊断的 DLBCL 患者进行的另一项大型回顾性研究表明,1年和3年心血管累积发生率分别为9.7%和14.7%;多变量分析显示年龄>60岁、BMI> 30 kg/m2和慢性肾衰竭病史是发生心血管事件的显著风险因素;此外心脏并发症多发生于诊治1年内的早期,且对远期生存有明显影响。DLBCL 管理的挑战在于其主要影响老年患者(中位发病年龄为70岁),而老年患者和伴基础心脏合并症的患者在接受含蒽环类药物治疗时发生毒性的风险最高。
DLBCL的非蒽环类一线治疗选择
经临床评估,部分患者接受蒽环类药物为基础的治疗的风险过高,包括:既存射血分数降低性心力衰竭的患者,癌症治疗后左心室射血分数 (LVEF) 下降>10%的患者,以及任何有活动性心力衰竭症状和/或需要心力衰竭治疗的患者。具有基础心脏合并症和蒽环类药物治疗禁忌的 DLBCL 患者有多种一线治疗方案(表1),包括用依托泊苷 (R-CEOP) 或吉西他滨 (R-GCVP) 等替代 R-CHOP 中的多柔比星。R-CEOP是一种有用的一线治疗替代方案,在 DLBCL 中具有治愈潜力,尽管大多数研究表明其疗效不如 R-CHOP,长期生存率较差,但仍有相当少数的患者可持续缓解;此外基础合并症和虚弱状态可影响 DLBCL 治疗反应。有基础心脏合并症的 DLBCL 患者中用吉西他滨替代多柔比星也有所探索。心脏合并症患者的另一种选择是用匹杉琼(R-CPOP)替代多柔比星,其与 R-CHOP 相比缓解率稍微降低但 PFS 和无事件生存期相似,而心脏事件更少。
从肿瘤学角度来看,简单地省略多柔比星并不那么有效。省略多柔比星的R-CVP 作为一线治疗与既往 R-CHOP 治疗方案相比转归较差,因此视为姑息治疗选择。苯达莫司汀和利妥昔单抗 (BR) 在不适合 R-CHOP 的患者一线治疗中可诱导高缓解率,但 OS 率通常较低,使其成为姑息治疗。非聚乙二醇多柔比星脂质体代替标准 R-CHOP中多柔比星的R-COMP方案的LVEF <50%率和NT-proBNP 升高率低于R-CHOP,临床心力衰竭发生率无统计学差异但 R-CHOP 组在数值上更高。R-mini-CHOP也是 R-CHOP 虚弱患者的常用方案,但通常不推荐用于对蒽环类药物有禁忌的心脏疾病患者。
接受一线治疗的DLBCL患者缓解心脏毒性的策略
DLBCL 患者中既存心力衰竭很常见 (13.9%),既存心力衰竭的患者不太可能接受蒽环类药物治疗,淋巴瘤相关死亡率较高,强调了心血管风险管理和有效淋巴瘤治疗的重要性。对于具有潜在心脏问题(例如既存心力衰竭)的初治 DLBCL 患者,有几种方法可以缓解与蒽环类药物给药相关的心血管风险,包括使用剂量减少方案(例如R-mini-CHOP)、多柔比星脂质体制剂(多西他赛)减少心肌药物蓄积、蒽环类药物输注(连续/缓慢静脉输注,而非静脉推注)及右丙亚胺合并给药,此外神经激素调节剂也具有一定心脏保护作用,如使用血管紧张素转换酶抑制剂、血管紧张素 II 受体阻滞剂、醛固酮拮抗剂和β受体阻滞剂。
专家共识建议接受蒽环类药物治疗的高危和极高危患者预防性使用血管紧张素转换酶抑制剂/血管紧张素 II 受体阻滞剂和 b 受体阻滞剂作为一级预防。如果患者发生 LVEF 下降,应根据指南给予射血分数降低性心力衰竭的药物治疗。此外,报道称他汀类药物在减少淋巴瘤患者阿霉素相关心功能不全方面具有潜在的有益作用,STOP-CA(Statins to Prevent the Cardiotoxicity From Anthracyclines,他汀类药物预防蒽环类药物的心脏毒性)研究将300例接受蒽环类药物治疗的淋巴瘤患者随机分配至阿托伐他汀每日 40 mg 治疗组和无阿托伐他汀治疗组,治疗12个月,阿托伐他汀组的 LVEF 下降率(≥10%至<55%)显著低于安慰剂组 (9% vs 22%;P=0.002)。尽管有必要进一步验证,但他汀类药物也可能对淋巴瘤患者的多柔比星提供心脏保护作用。最后,关键是让心脏病专家/心脏肿瘤学家参与合作评估淋巴瘤患者的心血管风险,在高危患者中实施上述心脏保护策略,并监测和管理任何心血管并发症(图1)。
案例报告-续
患者接受 R-CEOP 治疗6个周期,获得完全缓解但数月后出现淋巴结肿大和盗汗。此时PET/CT扫描示纵隔、腋窝和腹股沟区域淋巴结肿大,淋巴结活检证实 DLBCL 复发。
复发/难治性DLBCL的治疗:ASCT和CD19 CAR T
约1/3的 DLBCL 患者发生难治性或复发性 (R/R) 疾病,其标准治疗选择是挽救性化疗,之后接受卡莫司汀、依托泊苷、阿糖胞苷和美法仑 (BEAM) 的高剂量化疗和自体造血细胞移植 (auto-SCT) 巩固治疗或嵌合抗原受体 T 细胞治疗 (CAR-T),均可在部分患者中获得持续缓解。挽救性化疗后自体 SCT 传统上是 R/R DLBCL 的标准二线治疗,但有半数患者由于挽救治疗无效而不适合移植,另外半数患者会在 auto-SCT 后会复发。
基于关键性ZUMA-1、JULIET、和TRANSCEND研究,三款CD19 CAR T细胞产品axicabtagene ciloleucel(axi-cel)、Tislecagenleucel(tisa-cel) 和lisocabtagene maraleucel (liso-cel)分别获批用于三线治疗。后续3项关键研究ZUMA-7、BELINDA、和TRANSFORM评估了CAR-T 二线治疗用于初始化学免疫治疗后原发难治性或12个月内复发的患者,其中TRANSFORM失败,而lisa-cel和 axi-cel 均获批用于高危 DLBCL 患者的二线治疗,40%的患者缓解。基于这些结果,CD19 CAR-T目前已经成为原发难治性和/或早期复发的高危 DLBCL 患者的标准二线治疗。晚期复发的患者标准治疗是挽救性化疗后autoSCT。根据 II 期PILOT(Lisocabtagene maraleucel作为二线疗法治疗不宜接受造血干细胞移植的复发或难治性大 B 细胞淋巴瘤成人患者)研究结果,二线疗法 liso-cel 已成为治疗晚期复发且不适合接受移植的体弱患者的首选疗法。
自体SCT和CAR T的心脏毒性和心血管优化
自体SCT和 CD19 CAR-T 均有潜在心脏毒性。SCT 给予的大剂量化疗与发生 CVD (如心力衰竭和冠状动脉疾病加速)的显著风险相关,以及晚期发病率和死亡率风险。值得注意的是,SCT生存者中 CVD 相关死亡的风险是一般人群的2倍以上,因此预测哪些患者容易发生 CVD 在 SCT 后管理患者中至关重要。Armenian 等人最近发表了一个CVD 风险评分,用于预测接受 SCT 治疗且 SCT 后1年无临床明显 CVD,包括年龄、蒽环类药物剂量、胸部放疗、高血压、糖尿病和吸烟,高危组患者发生 CVD 的风险是低危组的7.8倍。
越来越多的心血管事件报告也与 CD19 CAR-T 治疗相关,包括低血压、肺水肿、心力衰竭、心律失常和心脏骤停。急性心脏毒性主要发生于细胞因子释放综合征 (CRS) 的背景下,由于免疫细胞本身的激活以及由此导致的肿瘤细胞裂解引起的细胞因子激增所致。心脏毒性的发生率通常与 CRS 的严重程度相关,若CRS开始发作与 IL-6 抑制剂托珠单抗给药之间的时间较短,则心脏毒性的发生率较低。研究发现,CD19 CAR T输注后第30天、第6个月和第12个月的主要心脏事件累积发生率分别为17%、19%和21%,提示 CAR T 不仅存在即刻心血管事件风险,而且存在长期心血管事件风险。基于202例接受抗 CD19 CAR-T 患者的多中心登记研究,Mahmood等报告16.3%(33/202) 的患者发生重度心血管事件,定义为心力衰竭、心源性休克或心肌梗死的复合终点。Alvi 等的一项研究报告,CAR T后肌钙蛋白升高与心血管并发症风险增加相关。总之,伴显著心血管合并症的复发性 DLBCL 患者将从心脏病专家/心脏肿瘤学家的心脏会诊和管理中获益,以进一步评估心脏风险并确定接受强化治疗(如自体 SCT 和 CAR-T 细胞治疗)的资格。此外还需要继续努力确定高危队列以及最小化心血管风险的策略。
其他的新药及其心脏毒性
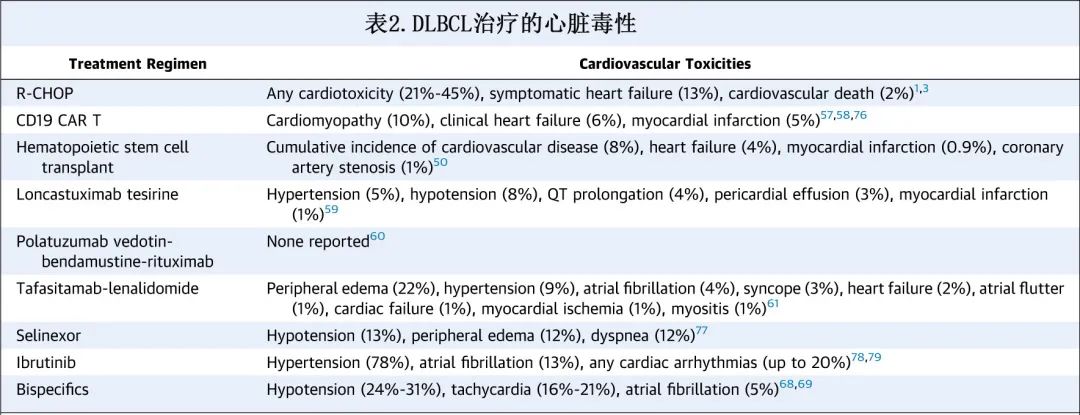
患有基础心脏合并症的不适合移植或不适合 CAR T 的 R/R DLBCL 患者,可考虑多种靶向药物和免疫治疗选择(表2)。靶向 CD19 的抗体药物偶联物 Loncastuximab tesirine(Lonca) 有效,ORR为48.3%,CR率为24.1%,中位缓解持续时间为10.3个月;28%的患者发生严重不良事件 (AE),发生率≥2%的事件为发热性中性粒细胞减少、肺炎、水肿、胸腔积液和败血症。考虑到水肿和胸腔积液的风险,有基础心脏问题的患者应慎用loncastuximab tesirine。维泊妥珠单抗(Pola) 是一种靶向 CD79b 的抗体偶联药物,与 BR 联合治疗不适合移植的 R/R DLBCL 患者,CR率为40%,中位 PFS 为9.5个月,中位 OS 为12.4个月;其主要治疗相关 AE 包括血细胞减少和周围神经病变。Tafasitamab(一种靶向 CD19 的单克隆抗体)联合来那度胺在不适合移植的患者中CR 率为43%,最常见的毒性为血细胞减少;值得注意的是51%的患者发生严重AE,其中≥2%的患者发生的严重 AE 为肺炎、发热性中性粒细胞减少、肺栓塞、支气管炎、房颤和心力衰竭。塞利尼索是一种 XPO-1 核出口的选择性抑制剂,基于28%的 ORR 也获批用于R/R DLBCL,最常见的3-4级 AE 为血细胞减少、疲乏、低钠血症和恶心,最常见的严重 AE 为发热、肺炎和脓毒症。其他靶向治疗选择包括BTK抑制剂如伊布替尼,其在non-GCB DLBCL 中显示出特殊活性,ORR为37%;但伊布替尼具有显著心脏毒性,包括出血增加、高血压、房颤和室性心律失常。尽管第二代BTKi(如阿可替尼和泽布替尼)治疗慢性淋巴细胞白血病的心血管安全性特征似乎有所改善,但从心血管角度来看,尚不清楚其治疗复发性淋巴瘤患者的安全性。最后,来那度胺单药治疗或与利妥昔单抗联合治疗也耐受良好,心脏毒性极小,且在 R/R DLBCL 中有效。尽管上述治疗选择均对 R/R DLBCL 有效,但大多数患者无法获得持久缓解。
多项进行中的临床试验正在评估新型疗法在 DLBCL 中的作用。双特异性 T 细胞衔接器是一类新的免疫疗法,目前正在 DLBCL 中研究几种双特异性抗体,包括mosunetuzumab、glofitamab(6月获得FDA加速审批上市)、epcoritamab(5月获得FDA批准上市)和odronextamab,早期数据均优秀,包括在 CAR-T 治疗后进展的多线治疗患者中。与 CAR-T 治疗相比,双特异性抗体具有有利的毒性特征,CRS和神经毒性的发生率较低,因此需要在有基础心脏合并症的患者中进行进一步研究。正在进行的试验还评价了靶向药物、靶向药物化疗和双特异性抗体与靶向药物的新型组合。
虽然随着多种新型疗法的出现,异基因干细胞移植 (allo-SCT) 治疗 R/R DLBCL 的作用已经减弱,但考虑到预处理方案的细胞减灭作用和移植物抗淋巴瘤作用,allo-SCT仍是多次复发患者的重要选择。然而异基因SCT 存在高死亡风险,死亡原因包括复发、感染、急性移植物抗宿主病、CVD和多器官衰竭。
放疗
放疗可在 DLBCL 中发挥作用,包括作为一线治疗(用于局限期疾病或大肿块的巩固治疗)和复发治疗(用于局部症状或病灶部位大肿块患者的挽救治疗或桥接治疗)。但心脏毒性是放射治疗的副作用之一,尤其是当输送至胸部区域时,心血管副作用包括短期副作用,如心包炎和心包积液,以及长期副作用,包括冠状动脉疾病、心律失常、心肌病、瓣膜功能障碍和心力衰竭。可增加辐射诱导心血管毒性的风险因素包括较高剂量辐射、暴露于心脏毒性化疗和既存CVD。
案例报告-续
患者采用优化心功能的内科疗法,给予CD19 CAR-T(lisocabtagene maraleucel)治疗。CAR T后1个月患者达到完全缓解,但3个月后出现腋窝淋巴结肿大,活检证实复发。目前正在接受 loncastuximab tesirine 单药治疗。
总结
DLBCL 是一种可治愈但侵袭性的NHL,目前的标准治疗存在心血管并发症的临床风险,此外大多数 DLBCL 患者年龄大于60岁,许多患者既存心脏合并症,这些患者可能需要调整治疗和替代治疗选择,从而优化疗效并将心脏毒性降至最低。
这些患者一线治疗的选择包括省略多柔比星或用心脏毒性较低的替代药物,同时与心脏病专家合作实施心脏保护治疗(如神经激素调节剂和/或他汀类药物)。在复发情况下,自体 SCT 和 CD19 CAR-T 是具有治愈潜力的标准治疗选择,但可能具有心脏毒性,因此需要在治疗前进行仔细的心血管风险评估,并在治疗后进行密切监测。近年来出现了新型免疫疗法和靶向疗法,其毒性低于 auto-SCT 和 CAR-T 疗法等强化疗法,但目前认为这些替代治疗无法治愈,缓解的长期持久性仍有待观察。
因此,在一线和复发背景下开发改善心脏疾病 DLBCL 患者的治疗仍是显著未满足的需求。心脏病专家和肿瘤学家之间的多学科合作,在解决 DLBCL 患者的可逆性心脏风险因素、医疗优化和监测治疗相关心脏毒性方面至关重要。在具有心血管风险因素的 DLBCL 患者中,前期心脏病学专家共同参与,以及与肿瘤学家合作管理心脏风险因素和 CVD,以优化结局和最小化 DLBCL 治疗毒性至关重要。
参考文献
Kambhampati S,et al. How to Treat Diffuse Large B-Cell Lymphoma: Oncologic and Cardiovascular Considerations.JACC CardioOncol . 2023 Jun 20;5(3):281-291. doi: 10.1016/j.jaccao.2023.05.001.


