J Immunother Cancer:PD-L1抑制剂atezolizumab(阿替利珠单抗)联合贝伐珠单抗治疗PD-L1高表达的非鳞状非小细胞肺癌(NS-NSCLC)患者的疗效和安全性
时间:2022-02-06 10:19:07 热度:37.1℃ 作者:网络
近期,Journal for ImmunoTherapy of Cancer杂志上发表了一项II期研究,主要是评估PD-L1抑制剂atezolizumab(阿替利珠单抗)联合贝伐珠单抗治疗PD-L1高表达的非鳞状非小细胞肺癌(NS-NSCLC)患者的疗效和安全性。

这是一项单臂II期研究,纳入PD- L1表达≧50%且无EGFR/ALK/ROS1突变的晚期NS-NSCLC患者。患者接受15mg /kg贝伐单抗+1200mg固定剂量atezolizumab。主要终点为中央审查委员会评估的客观缓解率(ORR)。次要终点为无进展生存期(PFS)、缓解期(DOR)、OS和安全性。
纳入39例患者,中位年龄为67岁(范围:41 75岁); 33例(84.6%)为男性,36例(92.3%)为目前吸烟者/既往吸烟者,33例(84.6%)为IVA/B期,26例(66.7%)患者PD- L1 TPS 为75%- 100% 。
中位随访时间为9.5个月(IQR 5.5-12.0),没有患者CR,25例PR,11例SD以及3例PD。ORR为64.1%(95% CI 47.18-78.80)。
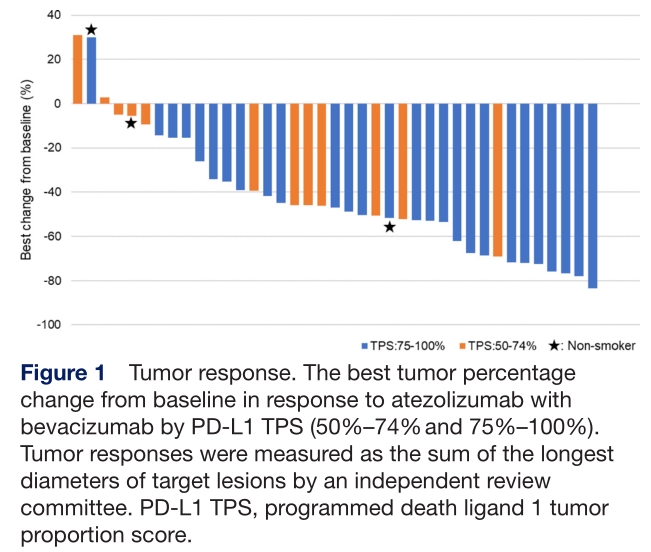
疗效评估
中位无进展生存期(PFS)为15.9个月(95% CI 5.65 - 15.93), 6个月和12个月无进展生存期(PFS)率分别为66.8% (95% CI 48.90 - 79.70)和54.9% (95% CI 35.65 - 70.60)。
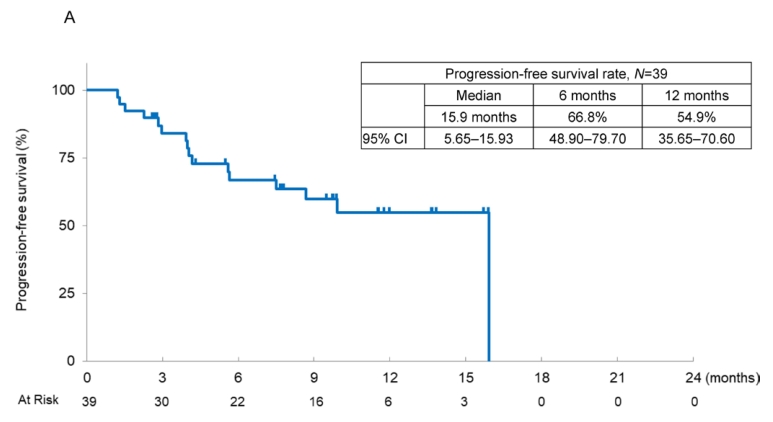
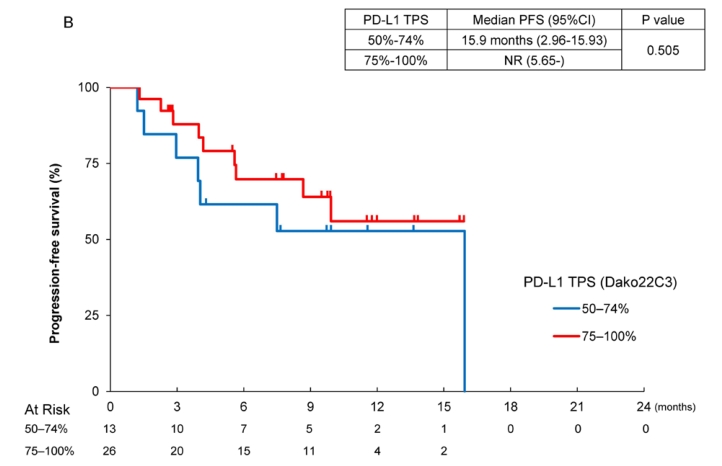
根据PD- L1 TPS水平分层, PD- L1 TPS 75%-100%患者的中位PFS未达到(95% CI 5.6-未达到),而PD- L1 TPS 50%-74%患者的中位PFS为15.9个月(95% CI 2.96 - 15.93)。
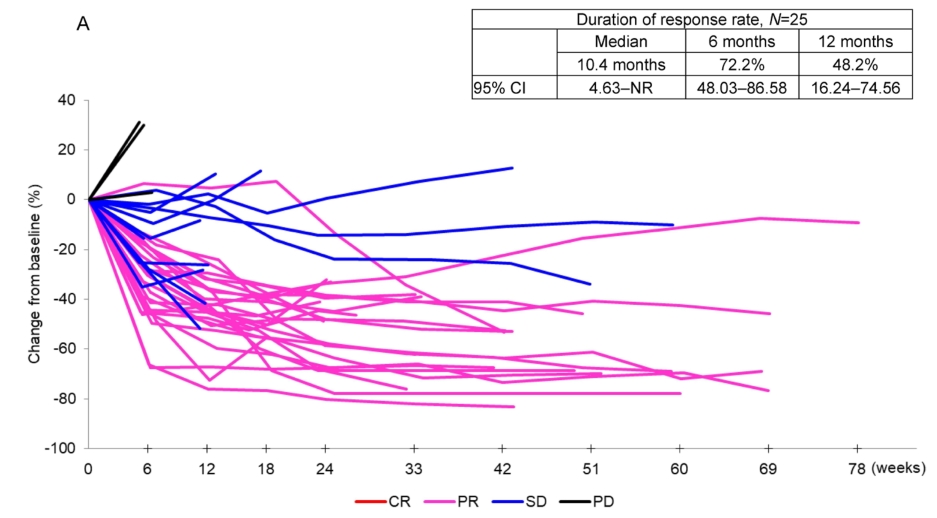
25名应答者的中位DOR为10.4个月(95% CI 4.6-未达到),独立复查委员会评估的6个月和12个月DOR率分别为72.2% (95% CI 48.03 - 86.58)和48.2% (95% CI 16.24 - 74.56)。
12例(30.8%)患者发生23种严重不良反应,无4/5级毒性。15例s(38.5%)患者出现33种3级AEs。发生率≧5%的AEs为高血压6例(15.4%),丙氨酸转氨酶升高3例(7.7%),天冬氨酸转氨酶升高2例(5.1%),肺部感染2例(5.1%),结肠炎2例(5.1%)。9例(23.1%)患者中观察到12种atezolizumab相关的严重不良反应,包括结肠炎和发热各2例(5.1%)。6例患者中观察到7种贝伐珠单抗相关的严重不良反应。在治疗期间无死亡病例,但有9例患者在随访期间因疾病进展而死亡。
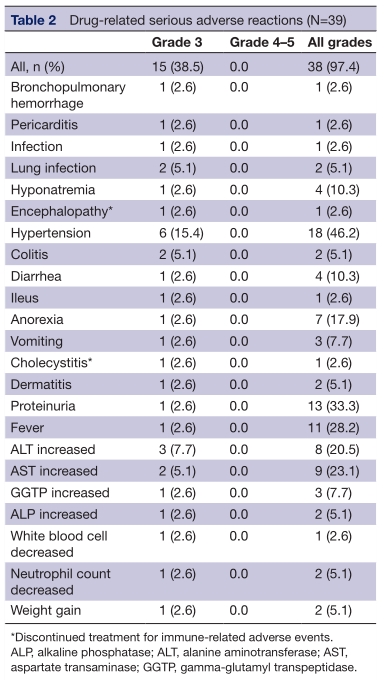
综上,研究表明,atezolizumab(阿替利珠单抗)联合贝伐珠单抗是PD-L1高表达的非鳞状非小细胞肺癌(NS-NSCLC)患者有前景的治疗方案。
原始出处:
Seto T, Nosaki K, Shimokawa M, et al. Phase II study of atezolizumab with bevacizumab for non- squamous non- small cell lung cancer with high PD- L1 expression(@Be Study). Journal for ImmunoTherapy of Cancer 2022;10:e004025. doi:10.1136/jitc-2021-004025


