病例讨论:免疫功能低下患者重症肺炎合并纵隔气肿
时间:2021-11-29 23:01:48 热度:37.1℃ 作者:网络
随着器官移植技术的突破和发展、肿瘤放/化疗等技术的进步致肿瘤患者的生存期延长、艾滋病的流行、激素和免疫抑制剂的应用等,免疫功能低下(immunocompromised host,ICH)患者明显增多并不断积累。肺部感染是ICH最常见的肺部并发症,起病隐匿,进展迅速,易发展为重症肺炎,预后较差。本文介绍一例ICH患者重症肺炎合并纵隔气肿。
临床资料
一般资料
患者,男,25岁,以“发热10 d,伴胸闷4 d,加重1 d”为主诉于2017年7月3日入院。
现病史
10 d前无明显诱因出现间断发热,体温最高39.8℃,伴畏寒、寒战、头痛,无咳嗽、咳痰、胸闷、气喘、胸痛,无腹胀、腹泻、腹痛、尿频、尿急、尿痛等不适,就诊于当地医院,诊断“肺部感染、IgA肾病”,给予抗感染、化痰平喘等对症治疗以及激素控制原发病治疗,效欠佳。
4 d前无明显诱因出现间断胸闷、气喘,多于活动后及坐位明显加重,继续给予抗感染、化痰平喘、高流量呼吸支持及对症治疗,仍间断发热,伴胸闷、气喘。1 d前上述症状加重,为进一步诊治收入院。
一般情况欠佳,睡眠好,大小便无明显异常,体重无明显异常。
既往史及其他
既往“IgA肾病”2个月余,规律应用环孢素(250 mg qd,1个月;225 mg qd,20 d;200 mg qd,10 d)、甲泼尼龙片(56 mg qd,2个月,后每周减1片至2017年6月20日)。
入院查体
入院时救护车护送至病房,面罩吸氧,10 L/min。体温38.0℃,脉搏102次/min,呼吸25次/min,血压128/76 mmHg。神志清楚,精神差,查体合作。双侧颈部及左上前胸壁可触及握雪感。双肺听诊呼吸音粗,两肺呼吸音减低,两下肺可闻及湿啰音。心律齐,各瓣膜听诊区未闻及杂音。腹部、四肢及神经系统查体未见异常。
入院后实验室检查
动脉血气分析(无创呼吸机辅助呼吸,模式CPAP,给氧85%):pH 7.484,PaCO2 31.7 mmHg,PaO2 107 mmHg,HCO3- 23.5 mmol/L,Lac 2.5 mmol/L。
血常规:WBC 5.6×109/L,RBC 4.09×1012/L,Hb 116 g/L,PLT 96×109/L,NEU% 94.9%。
血生化:肝功能、肾功能、电解质基本正常。
CRP 39.9 mg/L(参考值0~10 mg/L),ESR 34 mm/h(参考值0~15 mm/h),PCT 0.061 ng/ml。
G试验>600 pg/ml(参考值0~100.5 pg/ml),GM试验0.623 μg/L(参考值0~0.85 μg/L)。
治疗方案
入院后给予无创呼吸机辅助呼吸,模式CPAP,给氧浓度85%,压力支持12 cmH2O。患者为年轻男性,长期应用糖皮质激素及免疫抑制剂,发热、呼吸困难,氧合指数约为136 mmHg,考虑患者出现重症肺炎可能性大,急查胸部CT可见两肺透亮度减低,两肺片状密度增高影,两下肺伴有实变,双侧胸腔及纵隔内积气(图1)。
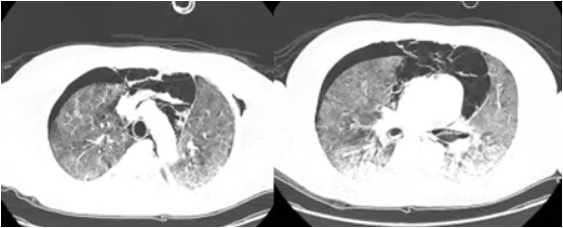
图1 患者胸部CT(2017-07-03)
行床旁纤支镜检查,留取肺泡灌洗液送检病原学检查。支气管肺泡灌洗液培养回示:铜绿假单胞菌、近平滑念珠菌生长,未发现耶氏肺孢子菌、奴卡菌等。
抗感染治疗:给予头孢哌酮舒巴坦针3.0 g q8h ivgtt、左氧氟沙星针0.6 g qd ivgtt、卡泊芬净针50 mg qd ivgtt(首剂70 mg)。虽然未查到耶氏肺孢子菌,结合患者长期应用糖皮质激素及免疫抑制剂,免疫力低下,结合影像学特点,不排除耶氏肺孢子菌感染,给予复方新诺明片160 mg q6h po。
对于纵隔气肿,结合胸部CT考虑积气量较大,且进行有无创通气,请胸外科会诊,拟于胸骨上窝处行切开引流减压,术中切皮后发现局部出血明显,遂终止操作,缝合皮肤。考虑患者目前循环稳定,既往长期应用激素及免疫抑制剂,若继续进行切开引流,出血、继发感染的可能性较大,遂暂不进行切开引流,密切观察皮下气肿的变化、胸闷情况及循环变化。经过治疗,患者症状逐渐好转,于2017年7月8日脱离无创呼吸机,给予高流量氧疗(给氧浓度50%,流量45 L/min)。
分别于2017年7月13日(图2)、2017年7月25日(图3)查胸部CT见两肺感染及双侧胸腔、纵隔积气逐步好转。患者病情逐步减轻,于2017年8月2日出院。2017年8月22日门诊复查胸部CT可见两肺少许条索影,双侧胸腔、纵隔积气消失(图4)。
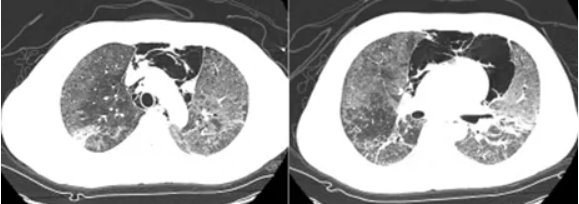
图2 患者胸部CT(2017-07-13)
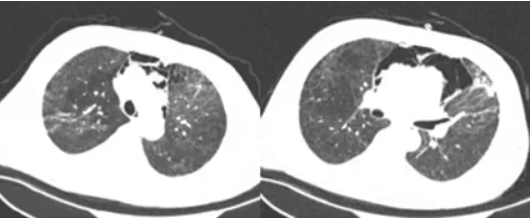
图3 患者胸部CT(2017-07-25)
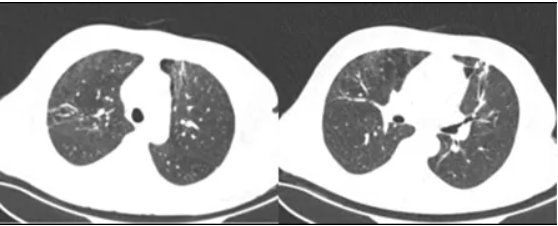
图4 患者胸部CT(2017-08-22)
免疫功能低下患者易合并肺部感染,且进展快速,病情危重,预后差。临床医生在给予经验性抗感染治疗时,应全面考虑可能感染的病原菌,尽量覆盖。本病例为重症肺炎合并纵隔气肿,更加棘手,为临床实践提供了很好的经验,具有较好的借鉴意义。
常见的免疫功能低下有粒细胞缺乏、器官移植、糖皮质激素及免疫抑制剂的应用、HIV感染、先天免疫缺陷及恶性血液病等。感染是影响ICH病程和预后的最重要因素,肺是感染的主要靶器官。ICH并发肺部感染,极易恶化,导致多脏器功能损伤,出现多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),临床死亡率高。本例患者基础疾病为IgA肾病,应用糖皮质激素与免疫抑制剂2个月余,出现重症肺炎,进展快,且合并纵隔气肿,病情危重,治疗难度大。
根据机制不同,ICH主要分为中性粒细胞缺乏或功能障碍、体液免疫受损和细胞免疫受损。本例患者长期应用糖皮质激素和免疫抑制剂,可同时影响体液免疫和细胞免疫,主要影响T淋巴细胞。ICH使患者的机会性感染发病率明显增高。与无ICH患者对比,革兰氏阴性杆菌、金黄色葡萄球菌、军团菌、奴卡菌、分枝杆菌、真菌、病毒等发病率升高。美国胸科学会与传染病学会指南指出,ICH患者常见感染细菌有金黄色葡萄球菌、铜绿假单胞菌、嗜麦芽窄食单胞菌、洋葱伯克霍尔德菌等[1]。当出现ICH时,真菌感染的概率会升高,尤其是曲霉感染[2]。本例患者支气管肺泡灌洗液病原学检测回报铜绿假单胞菌和近平滑念珠菌,未提示曲霉菌感染。另外,还需要注意隐球菌、青霉菌属、毛/根霉菌、组织胞浆菌等的感染。
ICH是肺孢子菌肺炎的高发因素[3]。研究发现,肺孢子菌感染发生的中位时间为免疫抑制治疗开始后2.4个月[4]。本例患者开始免疫抑制治疗2个月余,是肺孢子菌肺炎的高发时段。本病例病原学结果虽未提示肺孢子菌感染,但考虑患者存在高危因素,结合影像学特点,不能完全排除肺孢子菌感染,遂加用了针对肺孢子菌的治疗药物。
纵隔气肿是肺炎少见并发症,发病原因主要是各种原因引起肺泡破裂,空气在肺间质集聚,沿着血管束向肺门和纵隔发展(纵隔内的压力小于外周肺间质的压力),形成纵隔气肿。当有肺间质病变时,纵隔气肿的发生率升高[5],机制为肺间质病变引起肺泡内与肺泡外间质之间压力差梯度降低,使肺泡更易破裂。在支原体肺炎、病毒性肺炎、肺孢子菌肺炎、皮肌炎和肌炎等疾病中,纵隔气肿的发病率增高,这些疾病的组织病理表现中都存在肺间质成分的改变。有研究统计,在肺孢子菌肺炎中,纵隔气肿的发生率最高可达36%[6]。
对于纵隔气肿的治疗,当引起的气肿的原因去除时,气肿多可自行吸收。纵隔气肿的致命风险是压力上升对心脏和大血管的压迫,出现心脏填塞,导致循环衰竭。出现上述情况时,主要的处理方法是外科介入,进行切开引流减压。一项研究观察了600例患者,发现当气肿稳定、症状无加重、没有出现新的气肿相关并发症时,应保守治疗,不采取外科介入[7]。Mansbridge等[8]报道一例甲型流感病毒性肺炎患者合并纵隔气肿,未经外科介入,随着基础疾病的控制,气肿好转。
各种原因引起的气管、支气管破裂,进而出现纵隔气肿,往往压力上升快,多建议进行外科修补与引流。正压通气患者出现纵隔气肿是我们关注的问题。目前认为,正压通气患者一出现肺泡外积气,就预防性留置引流管是不可取的。但因纵隔气肿可能进展为气胸,尤其需注意张力性气胸,一旦出现气胸需置管引流,所以建议床旁备胸腔闭式引流包。正压通气患者出现纵隔气肿,尽早脱离正压通气很关键,同时在通气过程中尽量采取措施减少气体进入纵隔,例如尽可能减小潮气量和PEEP等。本例患者出现纵隔气肿,结合胸部CT,考虑积气量较大,且进行无创通气,遂请胸外科进行切开引流减压,因术中出血问题而终止。之后未再行外科介入,密切观察病情变化,随着肺部感染的好转,及时脱离无创通气,纵隔肿也逐渐吸收好转。
总之,ICH患者易合并肺部感染,快速进展,病情危重,预后差,需给予足够的重视。在给予经验性抗感染治疗时,要全面考虑可能感染的病原菌。合并纵隔气肿时,要充分评估病情,若气肿诱因可以去除,气肿情况相对稳定,没有出现新的气肿相关并发症,可以采取保守治疗,密切观察气肿变化,不建议积极行外科介入。
专家点评
邵润霞(郑州大学第二附属医院):
纵隔气肿指因各种原因使空气进入纵隔胸膜内结缔组织间隙之间,可以是自发性、胸部创伤、食管穿孔、医源性因素等引起。该症多见于新生儿和婴幼儿,成人重症肺炎合并纵隔气肿的病例鲜有报道。本文介绍一例ICH患者重症肺炎合并纵隔气肿患者成功救治的病例,并提供了一些经验和体会。首先,指出感染是影响ICH患者病程和预后的最重要因素,肺是感染的主要靶器官。ICH并发肺部感染,易快速进展,病情危重,预后差,需给予足够的重视。在给予经验性抗感染治疗时,要全面考虑可能感染的病原菌,特别是条件致病菌,本文虽未获得肺孢子菌肺炎的病原学依据,但经验治疗获得了较好结果。其次,ICH并发肺部感染易导致多种并发症,但纵膈气肿是肺炎的少见并发症,因此治疗过程中应密切观察病情变化,及时发现和处理并发症。本例及时发现患者合并纵膈气肿,并提出纵隔气肿的症状轻重主要与纵隔气肿发生的速度、纵隔积气量的多少、是否合并张力性气胸等因素有关。治疗纵隔气肿的关键在于采取积极措施控制原发疾病,若少量积气患者症状轻,也可以在严密观察下内科保守治疗等,供大家借鉴。
参考文献
[1] Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia[J]. Am J Respir Crit Care Med, 2005, 171(4):388-416.
[2] Pagano L, Mayor S. Invasive fungal infections in high-risk patients: report from TIMM-8 2017[J]. Future Sci OA, 2018, 4(6):FSO307.
[3] Liu Y, Su L, Jiang S J, et al. Risk factors for mortality from pneumocystis carinii pneumonia (PCP) in non-HIV patients: a meta-analysis[J]. Oncotarget, 2017, 8(35):59729-59739.
[4] Yang C Y, Yang A H, Yang W C, et al. Risk factors for Pneumocystis jiroveci pneumonia in glomerulonephritis patients receiving immunosuppressants[J]. Intern Med, 2012, 51(20):2869-2875.
[5] Park S H, Kum Y S, Kim K C, et al. Pneumomediastinum and subcutaneous emphysema secondary to amyopathic dermatomyositis with cryptogenic organizing pneumonia in invasive breast cancer: a case report and review of literature[J]. Rheumatol Int, 2009, 29(10):1231-1235.
[6] Boonsarngsuk V, Sirilak S, Kiatboonsri S. Acute respiratory failure due to Pneumocystis pneumonia: outcome and prognostic factors[J]. Int J Infect Dis, 2009, 13(1):59-66.
[7] Dajer-Fadel W L, Argüero-Sánchez R, Ibarra-Pérez C, et al. Systematic review of spontaneous pneumomediastinum: a survey of 22 years' data[J]. Asian Cardiovasc Thorac Ann, 2014, 22(8):997-1002.
[8] Mansbridge CT, Inada-Kim M. Pneumomediastinum Associated with Influenza A Infection[J]. N Engl J Med, 2018, 378(1):e1.


