杂合子原调蛋白3小鼠可改善慢性缺氧后肺血管化
时间:2021-11-03 10:02:04 热度:37.1℃ 作者:网络

导致高原肺动脉高压(HAPH)的分子机制仍然知之甚少。我们之前分析了吉尔吉斯高原人口的全基因组序列,并确定了八个在 HAPH 中具有潜在作用的基因组区间。原调节蛋白 3 基因 (TMOD3) 编码一种蛋白质,该蛋白质结合并覆盖肌动蛋白丝的尖端并抑制细胞迁移,是最重要的候选基因之一。在这里,我们系统地寻找其他证据来验证 TMOD3 的功能作用。研究分析显示,HAPH 相关基因组区间中的一些 SNP 位于可能导致 TMOD3 选择性剪接的调控区域。
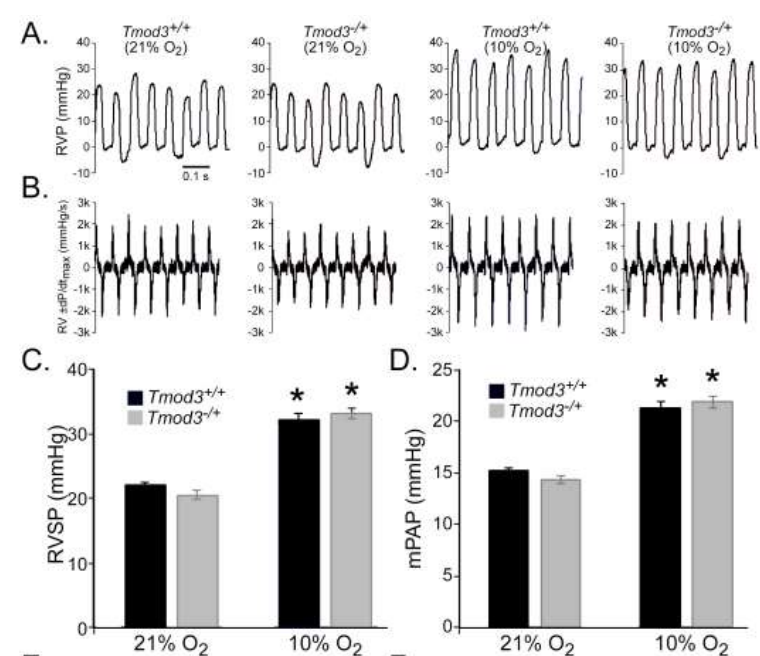
为了在功能上验证 TMOD3 在 HAPH 中的作用,我们将 Tmod3-/+ 小鼠暴露于持续缺氧 4 周,即 10% O2,并分析了与 HAPH 相关的功能(血流动力学测量)和结构(血管造影)参数。血流动力学测量值,例如右心室收缩压(肺动脉收缩压的替代测量值)和右心室收缩力(RV- ± dP/dt)随着缺氧而增加,在 Tmod3-/+ 和对照小鼠之间没有区别。值得注意的是,与对照相比,在持续缺氧 4 周后,Tmod3-/+ 中肺血管分支的数量和肺血管分支的总长度显着增加(p < 0.001)。Tmod3-/+ 内皮细胞的迁移也显着高于野生型同窝小鼠的迁移。我们的结果表明,在慢性缺氧条件下,较低水平的 Tmod3 在肺动脉的维持或新血管形成中起重要作用。
总之,此处提供的结果以及该团队之前对吉尔吉斯人口的全基因组分析的发现表明,较低水平的初级 TMOD3 转录物可能与吉尔吉斯高地人的 No-HAPH 相关。 由于该研究了解不同 Tmods 的不同功能作用,我们可以潜在地延迟结构重塑或通过使用可显着延迟 PH 进展的前瞻性 Tmod3 阻滞剂来恢复现有的前毛细血管床。 更重要的是,研究结果揭示了分子生物学和进化生物学之间关键联系的一个很好的例子。
参考文献:
Stobdan T, Jain PP, Xiong M, Bafna V, Yuan JX, Haddad GG. Heterozygous Tropomodulin 3 mice have improved lung vascularization after chronic hypoxia. Hum Mol Genet. 2021 Oct 28:ddab291. doi: 10.1093/hmg/ddab291. Epub ahead of print. PMID: 34718575.


