GUT:胃肠道肿瘤中的表观改变影响免疫检查点疗法的效果
时间:2021-08-29 15:01:58 热度:37.1℃ 作者:网络
在强大的宿主免疫监视下,肿瘤的生长和转移是癌症的一个标志。其中,免疫编辑是一个被肿瘤细胞利用的过程,肿瘤细胞通过抗原呈递的改变、免疫检查点的失调和免疫抗性克隆的选择等机制来逃避免疫识别。已有的研究表明,肿瘤可能通过同时利用表观遗传机制,如DNA甲基化、组蛋白乙酰化和染色质修饰来调节T细胞重编程、新抗原的产生和免疫基因的表达,从而加强免疫编辑。
研究人员曾描述过一种利用交替启动子对胃癌(或胃腺癌(STAD))进行免疫编辑的新机制。启动子的活动受到表观遗传学的调控,使用备用启动子可以产生不同的5′非翻译区和第一外显子,提高mRNA和蛋白质异构体的多样性。
通过表观遗传学分析,研究人员发现相当一部分STADs可以在高表达基因上使用备用启动子,产生5′截断的蛋白质异构体,其缺少免疫原性N端肽。研究人员还发现了大量使用备用启动子的STADs具有免疫学上的静息表型,并可能对免疫检查点抑制剂(ICI)治疗产生抗性。

因此,癌症中的表观基因组改变与免疫微环境相互作用,决定了肿瘤的演变和治疗反应。最近,研究人员进行了一项探索,旨在胃癌中研究通过表观遗传学交替启动子的使用来调节肿瘤的免疫微环境,并将其发现扩展到其他胃肠道肿瘤中去。
研究人员使用一种新的生物信息学算法(proActiv)对备用启动子负担(APB)进行了量化,从短读RNA测序中推断启动子活性,并将样本分为APBhigh、APBint和APBlow三组。此外,研究人员还进行了单细胞RNA测序来分析肿瘤内的免疫微环境。一个人源化小鼠癌症体内模型被用来探索肿瘤动力学、交替启动子使用和人类免疫系统之间的动态时间互动。随后,研究人员评估了用免疫疗法治疗的多个胃肠道肿瘤队列,以确定APB与治疗结果之间的相关性。
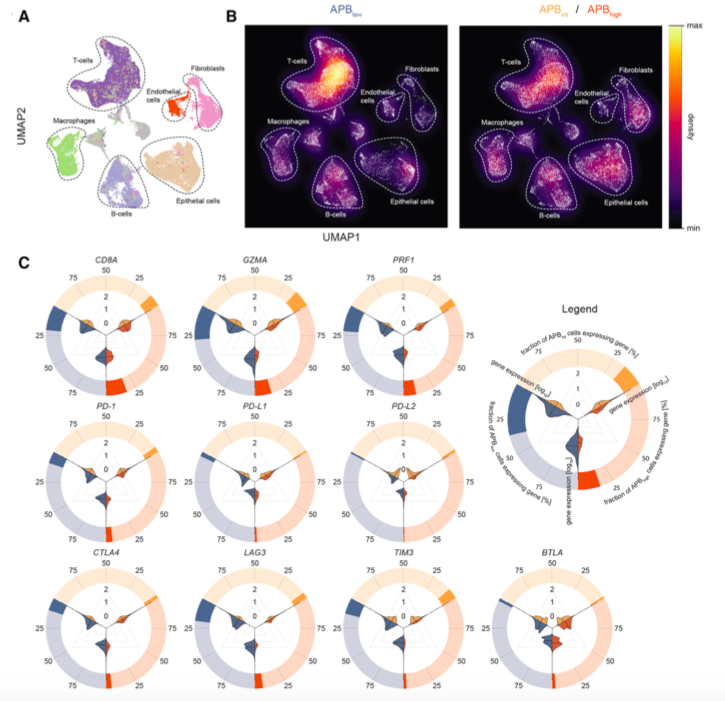
胃癌的单细胞RNA-Seq以及与APB和肿瘤微环境的关系
结果显示,APB高的胃癌肿瘤表示出T细胞的细胞溶解活性水平下降,并表现出免疫耗竭的特征。单细胞RNA测序分析证实了APB高的肿瘤中有不同的免疫群体和较低的T细胞比例。
使用带有活跃的人类免疫系统的 "人源化小鼠 "进行体内功能研究,研究人员还发现APB和肿瘤生长之间有明显的时间关系,APB高的肿瘤几乎没有人类T细胞浸润。
此外,对免疫疗法治疗的消化道癌症患者的分析证实,APB高的肿瘤对免疫检查点的抑制有抵抗力。与APBlow相比,APBhigh胃癌的无进展生存期明显较差(中位数55天对121天,HR 0.40,95%CI 0.18至0.93,P=0.032)。
因此,这些发现证明了交替使用启动子和肿瘤微环境之间的关联,其导致了免疫规避和免疫疗法的抗性。
原始出处:
Raghav Sundar et al. Epigenetic promoter alterations in GI tumour immune-editing and resistance to immune checkpoint inhibition. GUT (2021).



