心源性休克:急诊室管理要点
时间:2023-03-31 14:31:03 热度:37.1℃ 作者:网络
病例
患者男性,56岁,有冠状动脉疾病、饮酒相关疾病和近期心肌梗死病史,急诊诉最近一天出现气短。一个月前因左前降支100%闭塞,放置了支架。住院期间因多次并发心室颤动(VF),放置自动植入式心脏复律除颤器(AICD)。现脸色苍白,神情冷淡,浑身出汗。呼吸运动很吃力,听诊时全肺可闻及湿啰音,生命体征心率100次/分,血压160/100 mmHg,持续气道正压通气下氧饱和度为85%,呼吸频率30-40次/分,体温36℃,格拉斯哥昏迷评分为15分。就诊最初5min内,因两次独立持续性室速发作,AICD触发两次,成功转复到窄而复杂性心动过速,以100-150次/min的频率在房颤和房扑之间摇摆。
前言
心源性休克(CS)是泵衰竭的结果,特征是心输出量不能充分满足外周组织的氧需求。最常见原因是心肌梗死,其次是心律失常、心力衰竭和心脏瓣膜疾病。无论哪种刺激因素,其下游级联均有一个共同途径:心排血量减少导致心肌缺血,引发代偿性激素反应,产生恶性循环,促进进一步缺血。尽管还没有普遍接受的标准来定义心源性休克,但一些具有里程碑意义的试验,如SHOCK和IABP-SHOCK,提出了一组类似描述:低血压,终末器官低灌注,心脏指数<2.2 L/min/m2,肺毛细血管楔压≥15 mmHg(图1)。诊断心源性休克并非所需要满足所有标准。
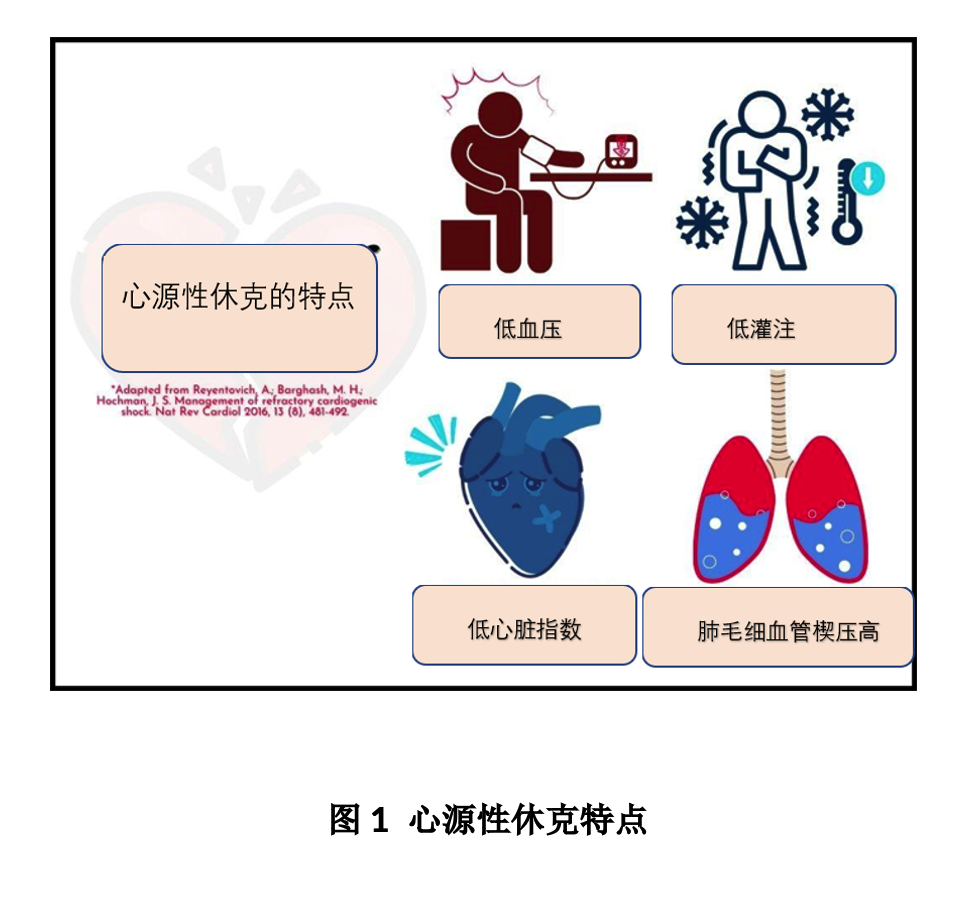
在急诊室,四个标准都可以通过良好的病史和体检、血液检查、心电图和床边超声来评估。SHOCK试验中的低血压定义为收缩压<90 mmHg,平均动脉压较基线下降>30 mmHg,或需要血管升压药维持收缩压>90 mmHg。体检如精神改变、排尿减少或四肢厥冷,或实验室标志物如血清乳酸>2.0 mmol/l,可发现终末器官灌注不足。通过床旁即时超声(POCUS)测量左室流出道(LVOT)速度时间积分(VTI)和左室流出道直径,计算出的无创心脏指数已得到反复验证。肺部充血,如啰音和低氧饱和度,提示肺毛细血管楔压升高,但这种发现可能不会一直存在。颈静脉压(JVP)已视为肺毛细血管楔压的另一个替代标记,ESCAPE试验显示颈静脉压≥12 mm Hg和肺毛细血管楔压≥22 mm Hg之间存在相关性。
在实践中,心源性休克有不同的初始表现,取决于失代偿的程度和哪一侧心脏受影响最大。心源性休克有四种典型的临床表现,可通过血流动力学状态和体检确定,并与死亡率相关(表1)。在这种分类中,患者分为“温”和“冷”两种表型,“温”指的是四肢温度,对应于全身血管阻力降低/远端血管扩张,“冷”指的是广泛血管收缩。四肢发热可能存在全身炎症反应综合征(SIRS)(在心源性休克恶化时很常见)或休克的混合模式。根据肺的状况和肺水肿的存在,患者进一步被分为“干型”和“湿型”。“湿型”大多表明右心室(RV)衰竭和高充盈压力导致的肺部充血,无此类表现可能有助于排除右心室衰竭和前负荷依赖。心肌梗死中,“冷-湿”型死亡率最高为51%,“热-干”型的死亡率相对最低为3%,“热-湿”型(9%)和“冷-干”型(23%)的相对死亡率中等。

治疗心源性休克的第一步是识别:急诊科评估未分类性休克的第一步是休克和低血压快速超声检查(RUSH),Daly等人(2020)在之前的emDocs帖子(http://www.emdocs.net/diagnosing-cardiogenic-shock-in-the-ed/)中已经介绍过。RUSH方案能对一些关键解剖结构快速评估,涉及休克的原因、代偿及休克类型。HIMAP助记法有助于指导临床医生完成所有检查部分:心脏(heart)、下腔静脉(IVC)、Morrison’s /创伤超声扩展评估(Morrison’s 方案/ E-FAST)、主动脉(aorta)和肺(pulmonary)。与CS一致的超声表现为:(1)左室收缩功能差;(2)下腔静脉充盈(> 2 cm/变异度没有> 50%);(3)胸部2+区域B线≥3条;(4)胸腔积液;(5)腹腔积液;(6) RV>LV的2/3。
病情稳定策略
通常情况下,临床医生应获得全套生命体征,包括脉搏血氧饱和度、呼气末二氧化碳测定(如可以)、心电图 (ECG) 和静脉 (IV) 液路(在心源性休克的情况下,能保留两条静脉液路更好)。
初始治疗应侧重于优化气道/呼吸/循环 (ABCs) 和寻找可逆性原因。
A –气道 // B –呼吸
无禁忌症且出现呼吸功增加、呼吸频率>25次/分或氧饱和度<90%的患者应启动无创正压通气(NIPPV)。一般来说,NIPPV对急性肺水肿是有益的,能增加肺泡内压力,有助于将液体从肺泡中移出,重新进入血管系统。还有助于恢复肺泡功能并保持肺泡张开。注意NIPPV可能对心源性休克有一些不利影响。胸内压升高会降低右心室前负荷,增加肺血管阻力(右心室后负荷),这可能导致已经右心衰竭的患者,低血压加剧。因此在血流动力学极不稳定的情况下,NIPPV往往是禁忌证。NIPPV同样禁用于精神状态改变者,在心源性休克中很常见。然而,这并不意味着任何心源性休克都应该立即插管。Hongisto等人(2017)的数据显示,将心源性休克患者随机分为NIPPV和立即插管并机械通气组,死亡率没有差异。虽然气管插管是一种可行选择,但与NIPPV相比,它确实有一些缺点。这些风险包括但不限于:诱导和镇静期间血流动力学受损、呼吸机相关性肺炎风险、需要持续镇静、需要更多重症监测以及需要更专业的培训。对于清醒、自主呼吸、遵医嘱、不主动呕吐、无严重面部畸形、不完全依赖前负荷的心源性休克患者,尝试NIPPV是合理的。
初始持续正压通气设置应从5-10 cmH2O压力开始,然后每次调整2 cmH2O向上滴定,以达到氧饱和度>92%的目标。最初推荐的双水平气道正压(BiPAP)设置是吸气正压(IPAP)为10 cmH2O,呼气末正压(EPAP)为5 cmH2O,根据需要将IPAP每次滴定上调2-3 cmH2O以纠正高碳酸血症。向上滴定EPAP,维持氧饱和度>92%。但避免IPAP >20 cmH2O,以减少胃胀气和误吸事件。
NIPPV尝试失败者(定义为精神状态下降,难治性缺氧或高碳酸血症,或最初30分钟至1小时内未能改善)应插管(药物建议见表2)。此外,初次出现精神状态改变、极端血流动力学不稳定/衰竭、主动呕吐、即将发生呼吸衰竭、极端酸碱紊乱、严重低氧血症或高碳酸血症的患者不应尝试NIPPV,而应插管。在诱导过程中建议谨慎,因为过高剂量的镇静药物会导致血流动力学波动(表2)。
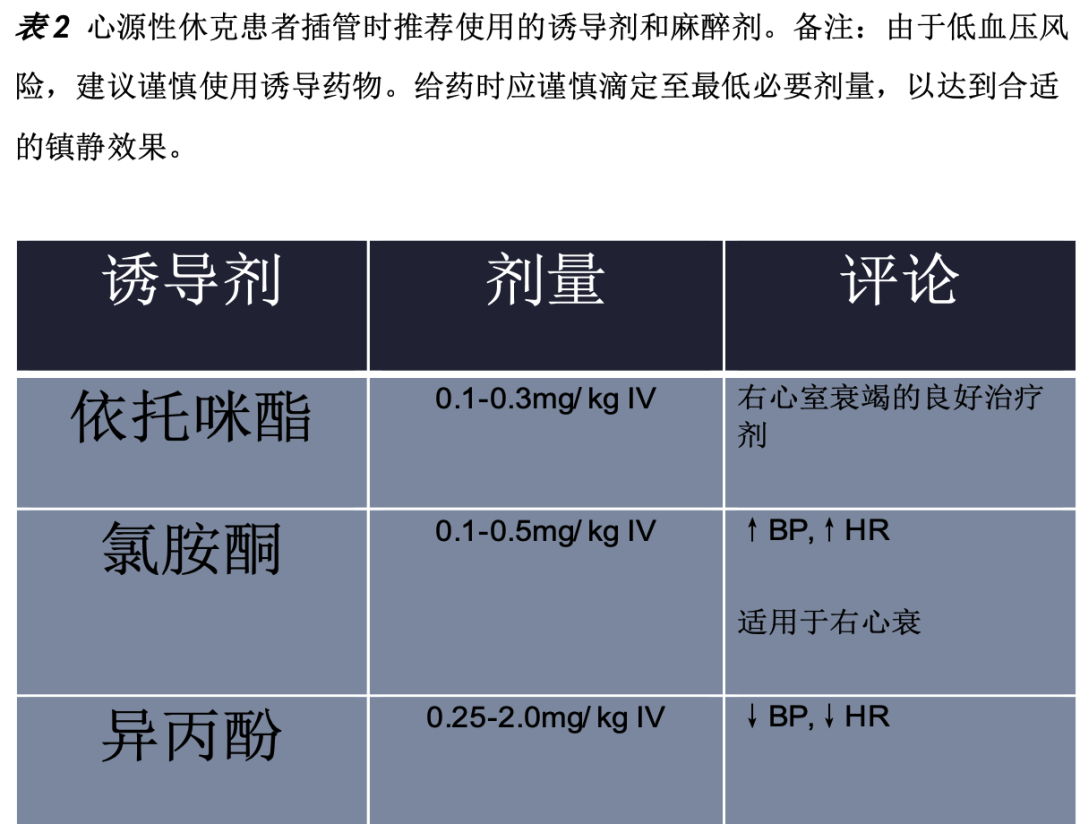
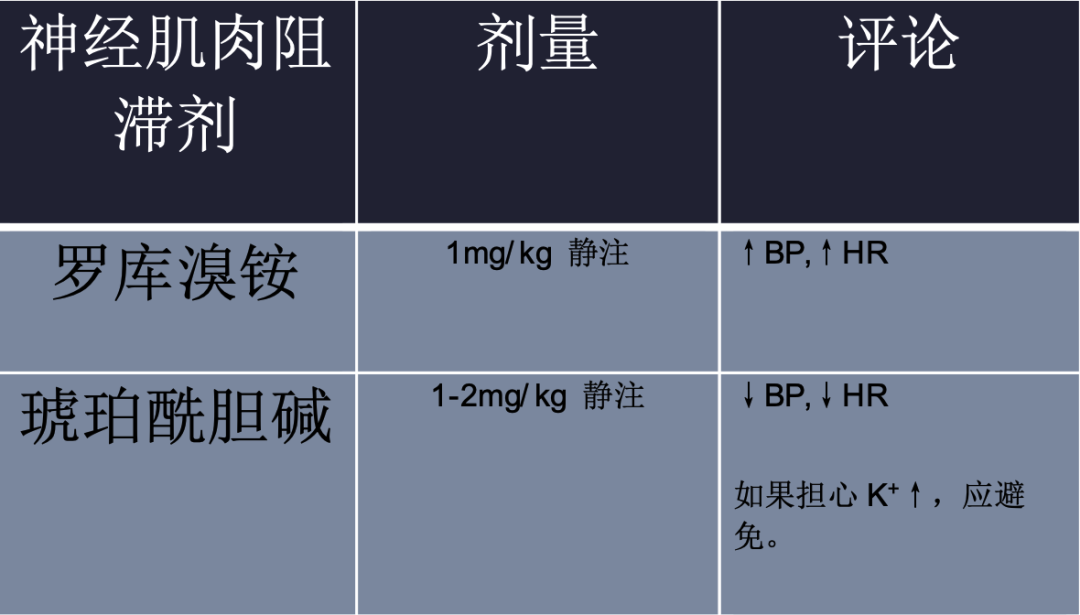
如果需要插管和机械通气,建议低潮气量(5- 7ml /kg理想体重),以减少肺血管阻力和右心室压力。呼气末正压(PEEP)的设置取决于哪侧心脏最弱;右心室衰竭,开始时正压为3-5 cmH2O,左心室衰竭,开始时正压为5-10 cmH2O。在右心室主导型心力衰竭(图2)中,中至高水平PEEP会通过减少右心室静脉回流、增加肺血管阻力和右心室后负荷来降低右室心排血量。舒张末期容积增加导致心室直径扩大,室间隔偏向左室,导致左室心排血量减少。相反,对于以左室为主的心力衰竭,中度至高PEEP会降低左室前负荷和后负荷,导致左室心输出量增加。吸入氧浓度(FiO2)设置为100%,并迅速滴定,以维持氧饱和度> 92%。没有指定一种最佳呼吸机模式,适用于所有患者,但建议不要使用同步间歇指令通气(SIMV)模式。SIMV可能会增加心肌需氧量,因为它不支持患者启动呼吸。
有一个明确共识是,每一次插管都应该避免在右心衰的情况下尝试。如果插管是必要的,清醒插管,氯胺酮诱导,可能是首选方法,因为在快速插管中会发生交感神经驱动丧失。需要维持全身血压高于肺动脉压,意味着在插管时要准备好或正在使用血管升压药。这种情况下,去甲肾上腺素经常作为一线血管升压药使用。避免缺氧和呼吸过度是必要的。插管后气道峰值压力应保持在最低水平,以降低胸腔内压,因为胸内压升高会降低前负荷,加重心源性休克。
注意:60-80%的心源性休克最终需要有创机械通气。

如果患者不能耐受面罩,不需要(或拒绝)气管插管,但仍处于缺氧状态,可考虑使用经鼻高流量(HFNC)。HFNC在心源性休克中还没有专门的研究,但已证明可以改善氧合,足以防止重症心源性肺水肿。对于严重焦虑的患者,HFNC更舒适,耐受性更好,皮肤皲裂更少,仍然会有降低呼吸频率和增加氧合的预期效果。HFNC的最高流量为60L/分钟,并可提供高达约7 cmH2O的PEEP。值得注意的是,HFNC对高碳酸血症无任何显著影响,因此如果 PCO2 升高,首选BiPAP呼吸机或气管插管。此外,HFNC对血流动力学有一定影响,在某些情况下,其对血流动力学的影响与 NIPPV 相当,应避免正压通气对血流动力学的影响。
//C–循环
患者之间的目标 MAP 可能略有不同,取决于基线血压,但合理目标是65-70 mmHg。目标MAP > 70 mmHg可能是有害的,除非患有慢性高血压。在慢性高血压的情况下,应根据充分灌注的体征(包括意识、尿量和体温)确定目标MAP,以指导血管加压药/正性肌力药的滴定。 一旦确定目标MAP范围,应注意保持在该范围内,以避免因超出该范围而不必要地增加心肌需氧量和心律失常频次。如果病人对MAP的变化特别敏感,并且很难保持在范围内,那么过总比不及要好。
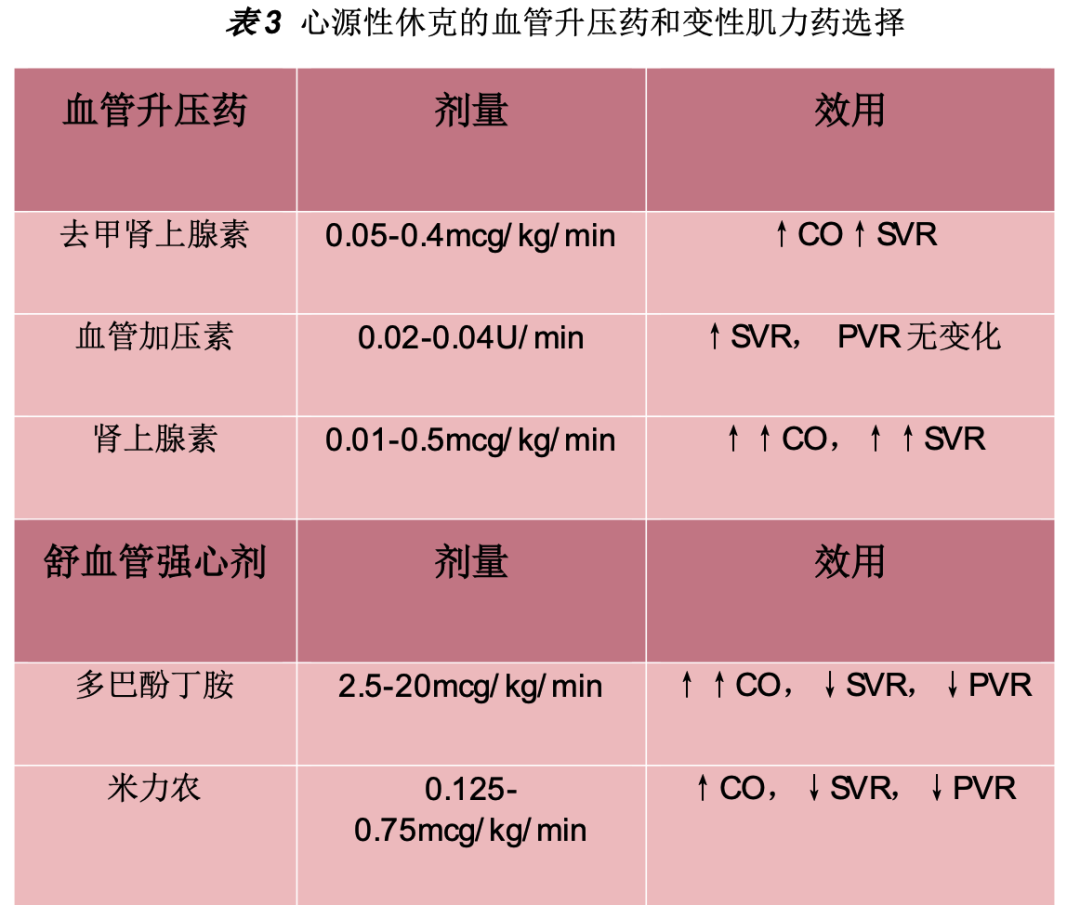
为了维持足够的灌注,心源性休克的常规策略是开始使用血管活性药,这会增加全身血管阻力(SVR)和血管收缩力(表3)。如果患者有任何心排血量差或低灌注迹象,加用此类药物——增加收缩力降低全身血管阻力。血管舒张剂从来不是心源性休克首选,因为单独使用时产生严重的血管舒张。虽然仍有争议,但去甲肾上腺素(NE)常用作心源性休克的一线用药。NE主要作用于α1受体,其次是β1受体,甚至更少的β2受体,因此其作用主要是增加SVR和心脏收缩力。动物模型中,NE可在不增加HR或血清乳酸的情况下增加心指数。在一项针对CS的多中心随机研究中,NE优于多巴胺,NE组死亡率降低,不良反应减少。
血管加压素是血管平滑肌V1受体的激动剂,可用作NE的辅助用药,增加SVR。原发性左心功能障碍患者应慎用,因为增加左心室后负荷而不增加收缩力。这种药物对严重肺动脉高压有帮助,因为不会增加肺血管阻力。不幸的是,目前缺乏用于心源性休克的证据,在这一特定背景下没有随机对照试验。肾上腺素具有强烈的α1、β1和β2激动作用,但不被推荐常规用于心源性休克。与NE相比,肾上腺素可导致心源性休克的MAP和心脏指数增加,但可能增加难治性休克的风险。肾上腺素也可能增加心源性休克的死亡风险。与肾上腺素相比,去甲肾上腺素/多巴胺联合使用在心源性休克中产生更高的心指数,而不会伴随HR的增加,也不会升高血清乳酸水平。多巴胺在心源性休克中已经不受欢迎,不建议单独使用,因为会增加氧耗和心律失常风险。
值得注意的是,心源性休克与其他类型低灌注状态相比,其表现部分由于泵本身衰竭,因此增强心脏功能本身在心源性休克的治疗中起着作用。Pirracchio等人发现,与单独使用升压药相比,添加一种变性肌力药(如多巴酚丁胺或PD-3抑制剂)与短期死亡率降低有关。对于左心室射血分数非常差的患者,多巴酚丁胺可作为去甲肾上腺素的辅助药物。多巴酚丁胺主要对β1受体有激动作用,收缩力和每搏量增加,但同时不增加SVR。应以低剂量开始,如2.0 mcg/kg/min,小剂量滴定达到效果。由于心肌需氧和室壁应力的激增,过高剂量会增加急性梗死面积(如果存在)。
另一种替代多巴酚丁胺的正性肌力药物是米力农,属于PD-3抑制剂,可以增加肌力并降低SVR。根据 OPTIME-CHF 试验 (2003),米力农治疗继发于缺血事件的心源性休克时结局较差,然而最近的DOREMI(2021)随机临床试验,在心源性休克中比较米力农和多巴胺,结果显示住院死亡率、需要机械循环支持或需要肾脏替代治疗之间没有差异。一些人建议将米力农与抗利尿激素联合使用,以抵消SVR的下降,特别是因长期β-阻滞剂(BB)治疗对儿茶酚胺不敏感的患者。
其他检查
除了体格检查和病史外,以下研究可能有助于心源性休克的诊断和阐明其根本原因:
· CBC、生化、肝功能检查、离子钙、镁、磷、肌钙蛋白、BNP)或NT-proBNP)、乳酸 ABG
· 尿液分析
· 心电图
· 床边超声
· 胸部X光片
管理
根据CS的潜在原因(如结构、收缩和梗阻),对其病因进行分类可能会有所帮助 (图3)。
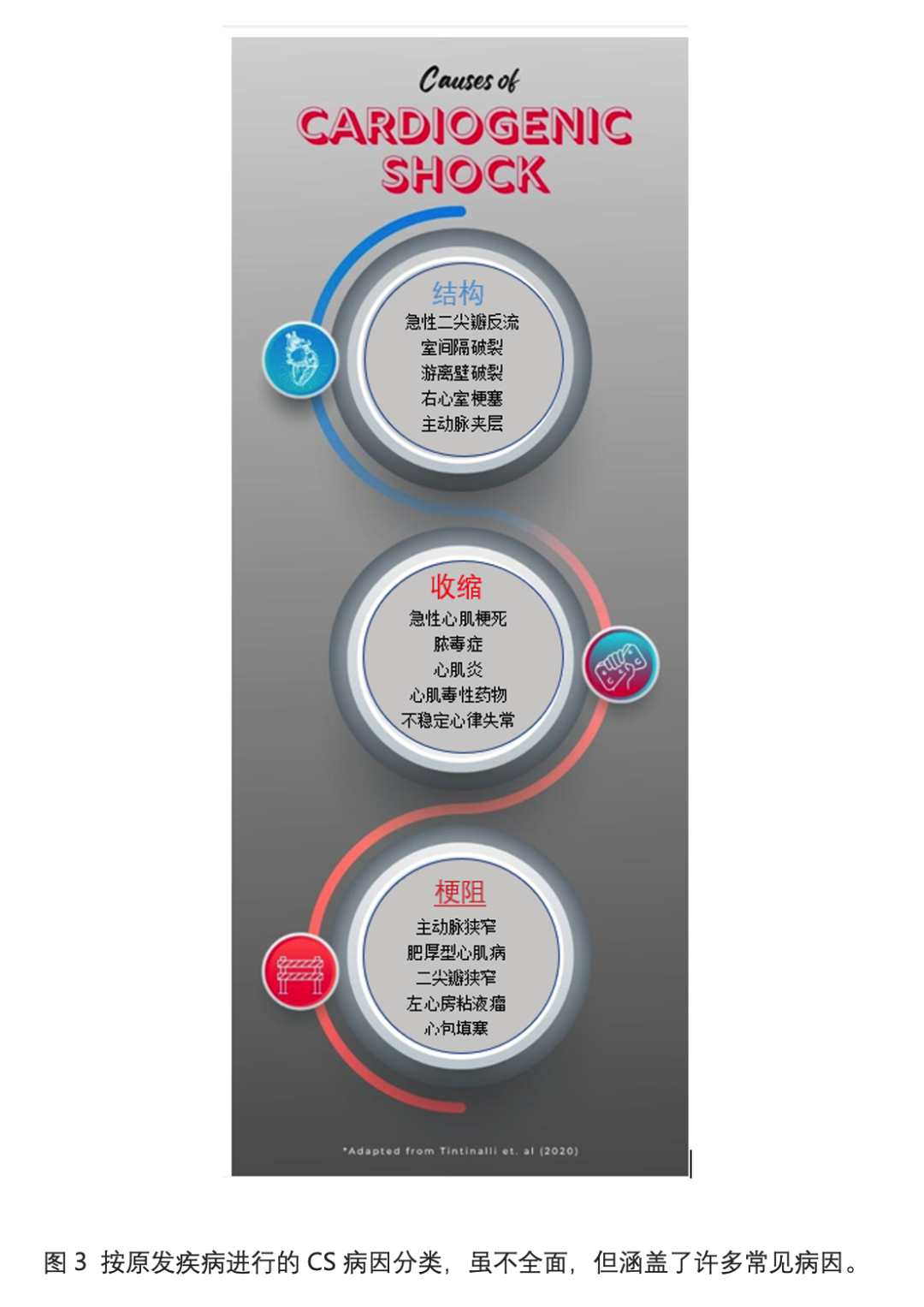
结构
表4总结了心源性休克的结构原因及治疗注意事项。下面将更详细地讨论每种原因。
急性二尖瓣反流
诊断依据:近7天内急性心肌梗死(AMI),全收缩期杂音,心尖最响,随应力而加重。
目标:(谨慎地)增加后负荷和早期手术会诊。
急性二尖瓣反流(AMR)常在原发损伤后2 - 7天作为急性心肌梗死的并发症发生。最常见的原因是后内侧乳头肌断裂,由于其右冠状动脉或左旋动脉单一的血液供应。AMR的其他原因包括心内膜炎的单叶穿孔、风湿性心肌炎的单叶炎症、Takotsubo心肌病和围生期心肌病。去甲肾上腺素是二尖瓣反流的一线血管升压药物。一旦使用血管升压剂稳定下来,就应该加入变性肌力药物。
这些患者对后负荷增加敏感,受益于早期主动脉内反搏泵(IABP)滴定时,使用尽可能低的灌注压。心胸外科医生的早期介入至关重要,因为如果不进行二尖瓣修复(如果需要手术修复,如AMI),死亡率接近80%。
室间隔破裂(VSR)
诊断依据:突发性心源性休克、新发全收缩杂音、心室扩张或多普勒超声显示心室之间有血流通过。
目标:减轻后负荷和早期手术会诊。
室间隔破裂(VSR)是急性STEMI发生率为0.3%的并发症,死亡率为40-80%。VSR中ED的治疗目标是减少后负荷以减少左向右分流。变性肌力药与血管扩张剂(硝普钠)的联合应用似乎是减少分流的最佳组合。单独使用血管升压药或收缩性药物会增加左向右分流,可能还会增加后负荷。机械循环支持装置,如ImpellaTM[与体外膜氧合(ECMO)结合时最有效]常用作手术修复或移植的桥梁。
游离壁破裂
诊断依据:7天内发生的心肌梗死,超声提示心包积液。
目标:优化前负荷和早期手术。
急性心肌梗死后左室破裂通常是立即致命的,存活下来的患者会出现心源性休克综合征。这种并发症发生在心肌梗死后第一周内,此时心肌最弱。心包积液超声检查几乎无一例外;对亚急性心肌梗死患者超声显示心包积液>5mm,诊断游离壁破裂的敏感性为100%。最终的治疗方法是手术缓解填塞和修复心室壁缺损。IABP通常用于在手术前帮助稳定血流动力学,但效果不一。VA-ECMO没有一致的数据显示这些患者的预后有所改善。最好将心包穿刺术留到手术室,因为打开心包可能导致失血性休克。如果不能立即进行心胸外科手术和药物治疗无效,可以尝试心包穿刺术,但在大多数情况下不建议这样做。
右心衰竭
诊断线索:三尖瓣反流,坠积性水肿,超声显示右心房(RA)/右心室比例增大,心电图电轴右偏/右束支阻滞/右心室肥大/右心劳损,胸片显示右心房/右心室增大。
目标:优化前负荷,积极治疗低氧血症,早期再灌注[如果AMI或肺栓塞(PE)]。
急性右室衰竭通常继发于急性心肌梗死或大面积肺栓塞。右室扩张导致室间隔偏向左室,降低左室心排血量。此外,由于缺乏前向血流,三尖瓣反流导致静脉充血。除了必要时的紧急血运重建,治疗的重点包括优化前负荷和谨慎使用变性肌力药物。呼吸机设置旨在积极治疗低氧血症,这将减少缺氧的肺血管收缩,从而降低右心室后负荷。PEEP设置应从3-5 mmHg开始。在可能的情况下,吸气时间应保持偏短,尽量降低平均气道压和右心室后负荷。右心室梗死可能出现严重的心动过缓,需要体外起搏。去甲肾上腺素和多巴胺是首选的抗利尿/肌力药物组合,伴有RV梗死或PE的心源性休克,普通肝素是首选抗凝药物。
主动脉夹层
诊断依据:突发性、危重、撕裂性、移动性胸/背/腹痛、脉搏短绌、神经系统病变、心包积液。
目标:控制HR/BP,控制疼痛,早期手术。
Stanford A型主动脉夹层(根据定义,涉及升主动脉)最有可能导致心脏并发症,包括心源性休克。A型夹层与主动脉反流、心脏填塞和冠状动脉口受压引起的急性心肌缺血有关。急性主动脉夹层的典型治疗方法是积极控制疼痛、血压和心率。A型需要紧急手术修复。目标收缩压在100-120mmHg之间,目标心率为60 bpm,以减少对主动脉壁的剪切应力,防止夹层恶化。
急性主动脉反流
诊断依据: 高调吹风样舒张期杂音,左侧第三/第四肋间最响。
目标:降低后负荷和早期手术。
急性主动脉反流(AAR)通常继发于心内膜炎、钝性创伤或主动脉夹层。AAR的最终治疗方法是紧急手术矫正,但可以使用硝酸甘油或硝普钠等血管扩张剂与正性肌力药物如多巴酚丁胺等联合使用,以帮助减少后负荷和增加射血。IABP在AAR中是禁忌的,因为舒张期会增加血液回流到LV。
收缩功能
表5总结了继发于收缩力受损的心源性休克原因及其治疗考虑,下面将更详细地讨论每种原因。
任何时代,美好之物都与金钱和闲暇无关。
创造出最美之物的,总是那些经过打磨的感知力,着眼于日常生活的目光,以及不懈努力的双手。
脓毒症性心肌病
诊断依据:发热,已知或可疑感染源。
目标:容量复苏,早期抗生素,传染源控制。
脓毒症诱导心源性休克的病理生理学尚不完全清楚,但Habimana等人(2020)提出了一个强有力论点,即(1)直接心肌抑制,(2)固有心肌循环功能障碍,(3)线粒体功能障碍。这类心肌病常以急性、无急性冠状动脉综合征 (ACS) 和原发损伤消退后的可逆性来定义。
脓毒症引起的心源性休克表现为以下部分或全部(通常):左室功能障碍、右室功能障碍和双心室扩张。此外,脓毒症诱发的心源性休克通常对静脉输液或初始血管升压药无效。急诊治疗包括迅速开始广谱抗生素治疗,识别和控制传染源,静脉输液。重要的是,静脉输液必须谨慎,因为有肺水肿风险,包括左室衰竭和肺毛细血管床的异常高渗透性。如果患者对液体无反应,去甲肾上腺素仍是首选的血管加压药物。
心肌炎
诊断依据:症状发作明显,病毒前驱症状,肌钙蛋白升高,缺血性心电图改变。
目标:容量优化和感染治疗
心肌炎是急诊科的疑难诊断,但也是引起心源性休克的重要原因之一。可在任何年龄发病,主要人群是青年和儿童。临床表现多种多样,最常见症状为呼吸困难和胸痛。关键病史特征包括就诊前2-4周内出现的明显症状和之前的病毒前驱症状,因为病毒感染是心肌炎的最常见原因。这些患者可有肌钙蛋白I水平升高和缺血性心电图改变,但不建议使用非甾体抗炎药(NSAIDs),因为会加重心肌损伤。此外,这些患者可能对血管升压剂和肌力药耐药。可能需要机械支持,如IABP或LV辅助装置。如果这些设备不能稳定心源性休克,可能需要转移到移植中心。
药物毒性/中毒
诊断依据:对变时性肌力药物耐药的心动过缓,已知或疑似摄入有毒物质。
目标:排毒、毒素特异性治疗。
多种药物在大剂量时有心脏毒性作用,包括I类抗心律失常药、β受体阻滞剂(BB)、钙通道阻滞剂(CCB)、三环抗抑郁药(TCA)、选择性血清素再摄取抑制剂(SSRIs)、多巴胺和去甲肾上腺素再摄取抑制剂(如安非他酮)、抗癫痫药(卡马西平、苯妥英)、噻嗪类、阿片类、抗疟疾药(氯喹)和可卡因。其中有几个值得特别提一下。
BB和CCB过量时,应采用大剂量胰岛素降糖治疗,根据需要进行大剂量胰高血糖素、钙、静脉晶体溶液和潜在心脏起搏试验。如果摄入时间在1小时内,可以考虑通过洗胃或灌肠排毒,但这些程序显著增加了非插管患者呕吐和误吸的风险。根据多项动物研究和人类病例报告,在CCB/BB过量时,心源性休克对血管升压药和收缩力药物特别不敏感。在大剂量胰岛素治疗的情况下,血管升压药似乎效果更好。患者可能需要某种机械支持,如IABP或ECMO。脂质乳剂治疗虽然也可以考虑,但如果尝试血液透析清除某种BB时(如阿替洛尔),应尽量避免应用。
TCA毒性通过减慢去极化过程中内向的钠电流来抑制心肌功能,并通过直接作用α受体产生拮抗作用,引起周围血管舒张。碳酸氢钠是一线治疗药物,它既能打破钠的封锁,又能碱化血液,减少TCA与钠通道的结合。在这种情况下,肾上腺素可能比去甲肾上腺素更有效。
一氧化碳引起组织缺氧,对心脏有直接毒性。一氧化碳中毒的一线治疗是通过非呼吸机、NIPPV或气管插管(ETT)给予100% 游离氧,如果临床有指征,则使用高压氧舱。仍推荐上述经典的血管升压剂/肌力剂组合,但它们可能加剧由一氧化碳引起的肾上腺素亢进状态
心肌挫伤
诊断依据:胸部钝性创伤伴心肌肌钙蛋白水平升高,缺血性心电图改变,超声示室壁运动减弱。
目标:优化前负荷,控制/治疗活动性出血,评估填塞。
心肌挫伤是胸部直接受到高能撞击的结果,是心源性休克的罕见原因。右心室由于位于胸腔前部,因此最易受影响。因此,这些病变经常产生前负荷依赖,这对急性低血容量和机械通气患者有影响。治疗应集中于静脉晶体液或血液制品的容量优化,并使用低PEEP来支持右心室功能。
不稳定心律失常
诊断依据:由心电图或心脏监护仪提供。
目标:控制节律。
对于任何引起心源性休克的不稳定心律失常,重点应放在终止心律失常,然后寻找潜在原因。对于不稳定的心动过速,电复律是首选。应特别注意纠正电解质异常(特别是镁和钾)和治疗甲状腺毒症(如果存在)。CCB在心源性休克中是禁忌的,所以如果房颤伴有快速心室率(RVR),则需要药物转复,胺碘酮(150mg /10分钟,接着1mg /分钟持续6小时,然后0.5 mg/分钟持续18小时)或地高辛(0.25 mg静脉注射,然后0.75-0.15 mg超过24小时)可以使用,除非怀疑有预激综合征(在这种情况下,需要普罗卡因酰胺)。使用地高辛作为抗心律失常药时应咨询心内科。持续性室速或室颤(VF)反复发作时,可使用胺碘酮,避免使用BB。这些患者尤其可能需要IABP、Impella(心室辅助系统)或ECMO的机械支持。
对于不稳定的缓慢型心律失常,应以经皮或经静脉起搏为主。推荐的干预药物包括阿托品、异丙肾上腺素、多巴酚丁胺和肾上腺素,尤其是常规治疗但心率仍难以控制时,考虑可能的原因是BB或CCB毒性、电解质紊乱或粘液水肿。
急性心肌梗死
诊断依据:心肌肌钙蛋白水平升高> 99%正常上限,心电图新发缺血性改变,新发病理Q波,缺血性症状(胸痛、呼吸困难、乏力),超声显示新发室壁运动异常。
目标:早期发现,早期再灌注,和/或早期转移到经皮冠状动脉介入(PCI)中心。
AMI是心源性休克病例的主要病因,占到70%,相对于非ST段抬高型心肌梗死(NSTEMI),心源性休克更可能由 STEMI引起。对于确诊AMI导致的心源性休克,最终治疗是再灌注治疗。通过以下部分或全部方法来完成:纤维蛋白溶解、PCI术和冠状动脉旁路移植(CABG)。这三者中,纤溶治疗在心源性休克中作用较弱,可能是因为其需要足够的灌注压才能改善循环。SHOCK试验比较了纤溶+ IABP与早期PCI或CABG + IABP治疗AMI并发心源性休克的患者,发现后者在短期和远期死亡率方面更胜一筹。在PCI组中,支架治疗组死亡率低于球囊血管成形术组。此外,经桡动脉PCI的患者比经股动脉PCI的并发症更少,死亡率也更低。急救医师应尽可能为心脏科医生保证右桡动脉结构的完整性。如果AMI后120分钟内不能进行PCI,则应给予纤溶治疗。
抗血小板药物和肝素是AMI的标准治疗方法,但在心源性休克的情况下有细微差别。心源性休克,像所有低灌注状态一样,肠内血流量减少,因此口服(或直肠)药物吸收减少。因此除非经静脉给药,心源性休克的血小板抑制作用也会减弱。目前美国心脏协会(AHA)指南表示,如果肠道吸收存在问题,建议使用静脉阿昔单抗(糖蛋白IIb/IIIa抑制剂)或坎格雷罗 (P2Y12抑制剂);然而IABP-SHOCK试验发现,在AMI继发心源性休克患者中,氯吡格雷、普拉格雷和替格瑞洛的死亡率没有显著差异。基于现有的少量研究,阿司匹林在休克状态下的抗血小板作用似乎并没有降低,因此可以按照标准剂量给药。目前推荐使用普通肝素(UFH)而非低分子肝素(LMWH),以避免急性心肌梗死患者对肾脏造成不必要的压力。
梗阻
表6总结了继发心源性性休克的梗阻性原因及治疗注意事项,下面将更详细地讨论每种原因。
主动脉严重狭窄
诊断依据:收缩中期高调喷射性杂音,胸骨右上缘最响,颈动脉脉冲减弱/延迟,近期(特别是运动诱发)晕厥。
目标:避免增加不必要的后负荷,因为这会阻碍舒张期冠状动脉灌注。减轻前负荷(谨慎地)。
考虑使用肾上腺素作为初始血管加压药,以避免心动过速引起的舒张期充盈时间缩短。α受体介导的后负荷增加影响在主动脉瓣水平,由此产生的 SVR 增加可诱发反射性心动过缓,可增加心脏充盈改善供需不匹配。如果需要小幅度增加收缩力,应该使用去甲肾上腺素。避免使用血管扩张剂,因为它们会加重前负荷。如果需要使用收缩性药物,尽量使用最低剂量。
当这种情况出现症状时,最终治疗是瓣膜置换术。由于心源性休克患者手术中极不稳定,通常需要主动脉瓣球囊成形术和/或机械循环支持(即IABP, ECMO)作为手术置换术前的临时措施。
二尖瓣狭窄
诊断依据:舒张期开瓣音及舒张期低音-渐强性杂音。
目标:优化前负荷和缓解心动过速。
这是一种前负荷依赖状态,因此谨慎输入晶体类药物是有必要的。如果需要使用血管加压剂,首选肾上腺素或垂体后叶素。胺碘酮或艾司洛尔可用于减慢心率,并允许足够的舒张充盈时间。
明确的治疗方法是二尖瓣球囊成形术,但在心源性休克背景下的预后很差。
肥厚性心肌病
诊断依据:晕厥发作,胸骨左缘处收缩期喷射样杂音,渐强-渐弱。
目标:增加前负荷,纠正心动过速,增加后负荷。
这是LVOT梗阻(LVOTO)最常见的原因。另一个值得注意的原因包括Takotsubo心肌病。容量耗竭和收缩增强会加重LVOTO,如脓毒症、脱水或贫血。因此治疗包括“容器充盈”——如果需要,用静脉晶体液或血液补充容量——并增加SVR。一线血管升压药是肾上腺素,其次是垂体后叶素,最后是去甲肾上腺素。强心药物是禁忌,因为它们加剧动态LVOTO。同样应避免使用血管扩张剂,因为其会恶化前负荷。
左心房(LA)粘液瘤
诊断线索:舒张期“肿瘤啪嗒”声,心电图LA增大,胸片心脏增大,右心衰征象,可表现为中风症状。
目标:优化前负荷和早期手术会诊。
绝大多数心脏黏液瘤位于LA,当其阻塞二尖瓣并导致右心衰时可引起心源性休克。最终治疗方法是手术切除。
心包填塞
诊断线索:奇脉、ECG上低电压或电交替、心包积液伴舒张期RV塌陷、收缩期RA塌陷、超声IVC充血。
目标:谨慎增加容量,(可能)提高心率,心包穿刺。
有些患者在严重心包填塞的情况下可能需要容量补充,以防止右心衰竭,但应该谨慎进行,因为可能很快就会出现容量过负荷。由于每搏量有限,如果需要增加心率来增加心排血量,肾上腺素可能比去甲肾上腺素更适合作为一线药物。心包穿刺术(在超声引导下)是最终的治疗方法,急诊紧急情况下应该尝试。
病例结论:
患者胸片显示双侧胸腔积液,广泛肺水肿,肺门充血。床旁超声示心尖及前壁运动减弱,二尖瓣返流,主动脉瓣僵硬。实验室检查显示白细胞轻度增多、肌钙蛋白升高、BNP升高、转氨酶轻度升高、血糖高和乳酸升高。患者改用BiPAP,开始滴注胺碘酮,经验性抗生素,速尿利尿。病情好转,住进重症ICU。在ICU开始使用多巴酚丁胺和速尿。一周后病情稳定出院回家。
要点和难点
- 近期心肌梗死是CS的最常见病因。
- 除非有明显禁忌症,否则去甲肾上腺素通常是CS患者的升压药物。
- 右心室受益于低PEEP,左室受益于高PEEP。
- NIPPV/HFNC是CS呼吸窘迫的一线干预措施,但如果需要插管,建议使用血流动力学稳定的诱导药,如依托咪酯和氯胺酮。
- 重要是要了解 CS 的主要原因,因为治疗因病因而异。
- 所有情况的心源性休克避免使用CCB。


