国家药品不良反应监测年度报告(2020年)
时间:2021-06-19 23:06:43 热度:37.1℃ 作者:网络
为全面反映2020年我国药品不良反应监测情况,提高安全用药水平,更好地保障公众用药安全,国家药品不良反应监测中心组织编撰《国家药品不良反应监测年度报告(2020年)》。
第1章 药品不良反应监测工作情况
2020年,面对突如其来的新冠肺炎疫情,全国各级药品不良反应监测机构上下同心,全力以赴,按照习近平总书记对食品药品“四个最严”要求,药品不良反应监测评价工作平稳有序开展,法规制度不断完善,监测评价体系逐步健全,报告数量和质量稳步提升,风险控制手段更加成熟,各项工作取得明显成效,为药品监管提供了科学有力支撑。
一是强化顶层设计,规划体系能力建设目标。发布《关于进一步加强药品不良反应监测评价体系和能力建设的意见》,明确“十四五”期间监测评价体系和能力建设的六项目标、九项任务和三项保障,加快完善监测评价制度体系,不断提高监测评价能力。
二是落实法规要求,推动配套技术规范出台。发布《药物警戒委托协议撰写指导原则(试行)》,起草《药物警戒质量管理规范》,指导药品上市许可持有人(以下简称持有人)开展监测、报告、分析和评价工作,推动药物警戒制度建立健全。
三是科学分析评价,充分发挥技术支撑作用。密切关注国内外监管动态,强化监测数据分析评价。根据评价结果,及时发布药品安全警示信息。2020年发布注销安乃近注射液等品种药品注册证书公告共3期,发布药品说明书修订公告共47期。
四是有效监测风险,保障疫情防控用药安全。面对疫情,全国各级监测机构迅速响应,密切跟进《新型冠状病毒肺炎诊疗方案》所列药品,重点关注相关预警信号、群体事件及药品不良反应报告情况,全面加强新冠肺炎防控及治疗药品监测、分析和评价,切实保障疫情防控用药安全。
五是升级信息系统,助力监测评价工作发展。加快转化实施ICH E2B(R3)数据标准,建成兼容在线报告、网关传输、XML文件递交多种报告途径的药品上市许可持有人直报系统。继续加强与医疗机构的合作,迄今为止,已在全国366家三级医疗机构建立药品不良反应监测哨点。
第2章 药品不良反应/事件报告情况
2.1 报告总体情况
2.1.1 2020年度药品不良反应/事件报告情况
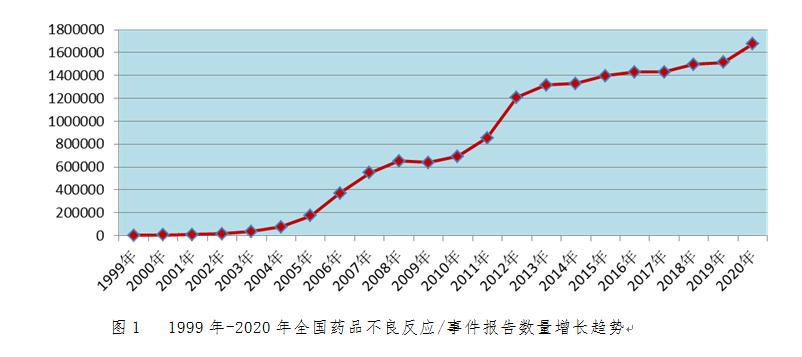
2020年全国药品不良反应监测网络收到《药品不良反应/事件报告表》167.6万份。1999年至2020年,全国药品不良反应监测网络累计收到《药品不良反应/事件报告表》1,687万份(图1)。
2.1.2 新的和严重药品不良反应/事件报告情况
2020年全国药品不良反应监测网络收到新的和严重药品不良反应/事件报告50.6万份;新的和严重药品不良反应/事件报告占同期报告总数的30.2%。
2020年全国药品不良反应监测网络收到严重药品不良反应/事件报告16.7万份,严重药品不良反应/事件报告占同期报告总数的10.0%(图2)。


